1.1.1 总体概况
根据摩熵医药数据库统计,2025.11.10-2025.11.16期间共有86个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号64个,进口药品受理号22个。
本周共计64款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药27款,生物药31款,中药6款。其中值得注意的有:
(1)[225Ac]Ac-FL-020注射液
11月10日,CDE官网公示:辐联科技的[225Ac]Ac-FL-020注射液获得临床试验默示许可,拟用于前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)。
公开资料显示,[225Ac]Ac-FL-020是辐联科技正在开发的创新型下一代PSMA靶向放射性药物偶联物(RDC)。该药物旨在治疗mCRPC,其采用靶向α放射疗法,可精准靶向癌症细胞,减少对健康组织的损伤。
(2)注射用AN-8025
11月12日,CDE官网公示:阿诺生物的注射用AN-8025获得临床试验默示许可,拟用于不可切除晚期或转移性实体瘤(包括但不限于对抗PD-L1/抗 PD-1治疗耐药的晚期非小细胞肺癌和黑色素瘤)。
公开资料显示,AN8025是一款融合了αPDL1、LAG3变体、CD86变体的三特异性抗体融合蛋白。其基于已获批的αPD-L1抗体,并与功能优化的CD86和LAG3变体蛋白融合而成,可调节T细胞和抗原呈递细胞(APC)功能。
(3)注射用LM-350
11月12日,CDE官网公示:礼来的注射用LM-350获得临床试验默示许可,拟用于治疗晚期实体瘤(如结直肠癌等)。
公开资料显示,LM-350是一款靶向CDH17的ADC,能够高度选择性地结合CDH17,具有很强的内化能力。LM-350采用IgG1野生型构型,同时具备抗体依赖细胞介导的细胞毒性作用(ADCC)活性。
本周4款新药获批上市,11月10日,国家药监局发布药品批准证明文件送达信息:诺华公司的镥[177Lu]特昔维匹肽注射液的两个适应症同时获得国家药品监督管理局批准,分别为用于治疗既往接受过雄激素受体通路抑制剂(ARPI)后疾病进展且适合延迟化疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)成人患者和既往接受过ARPI和紫杉类化疗后疾病进展的PSMA阳性mCRPC成人患者。作为国内首个且目前唯一获批的靶向PSMA的放射配体疗法药物,镥[177Lu]特昔维匹肽注射液的这两个适应症此前均获得优先审评认定,此次同时获批,有望为更多治疗选择有限的中国晚期前列腺癌患者,提供延长生存并改善生活质量的全新治疗方案。
立力科进口的沙瑞环素片获批上市,用于治疗9岁及以上患者非结节性中度至重度寻常痤疮的炎症性病变。公开资料显示,沙瑞环素是Paratek Pharmaceuticals开发一种针对中度至重度痤疮患者的创新疗法,这是一种首创、窄谱四环素衍生抗生素,具有抗炎作用。
赛诺菲的注射用卡普赛珠单抗获批上市,用于治疗血浆置换和免疫抑制疗法联合治疗获得性血栓性血小板减少性紫癜(aTTP)(也称为免疫介导的血栓性血小板减少性紫癜),适用群体范围为成人和12岁及以上体重至少40 kg的青少年患者。公开资料显示,卡普赛珠单抗(Caplacizumab)是一种针对vWF的纳米抗体,旨在抑制vWF和血小板之间的相互作用。
11月14日,国家药监局发布药品批准证明文件送达信息:派格生物医药的维派那肽注射液获批上市,用于改善成人2型糖尿病患者的血糖控制。公开资料显示,维派那肽属胰高血糖素样肽-1 (GLP-1)受体激动剂,也是一款周制剂聚乙二醇化艾塞那肽。经聚乙二醇定点修饰的PB-119充分保留了GLP-1受体激动剂的作用,包括改善胰岛β细胞功能,葡萄糖依赖性促进胰岛素分泌,低血糖风险低;诱导胰岛β细胞新生和增殖,并抑制细胞凋亡,从而增加胰岛β细胞数量。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
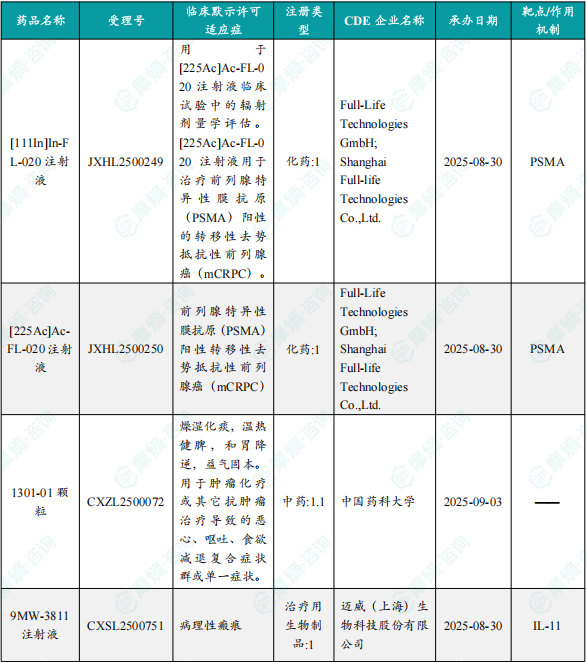
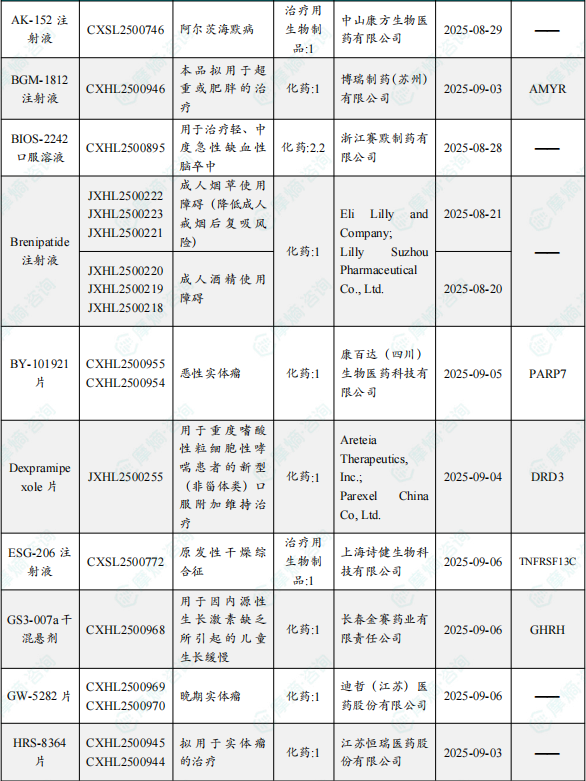
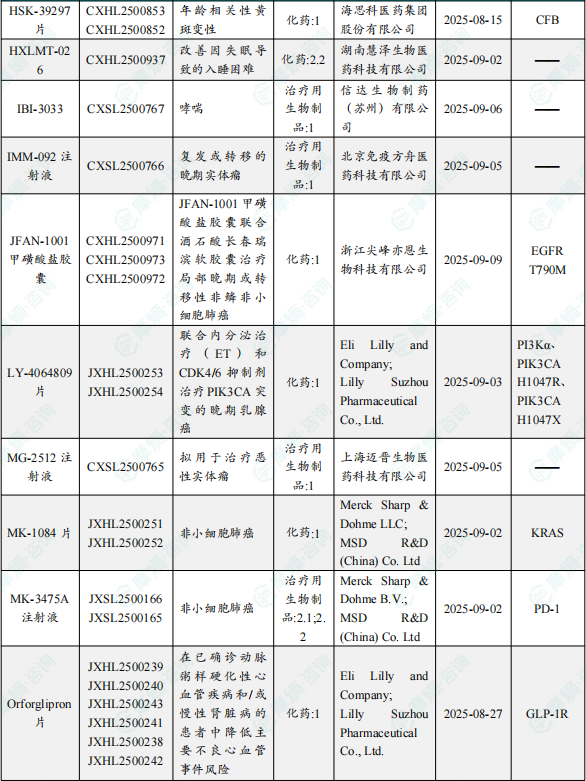
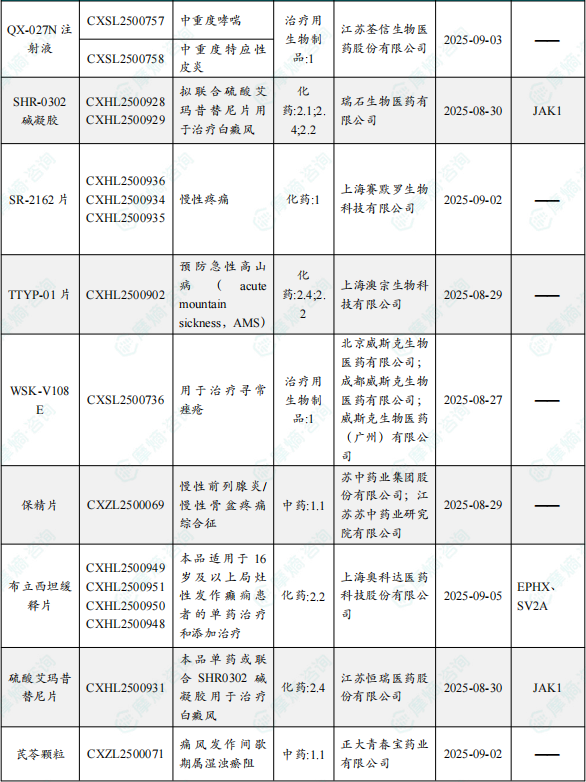
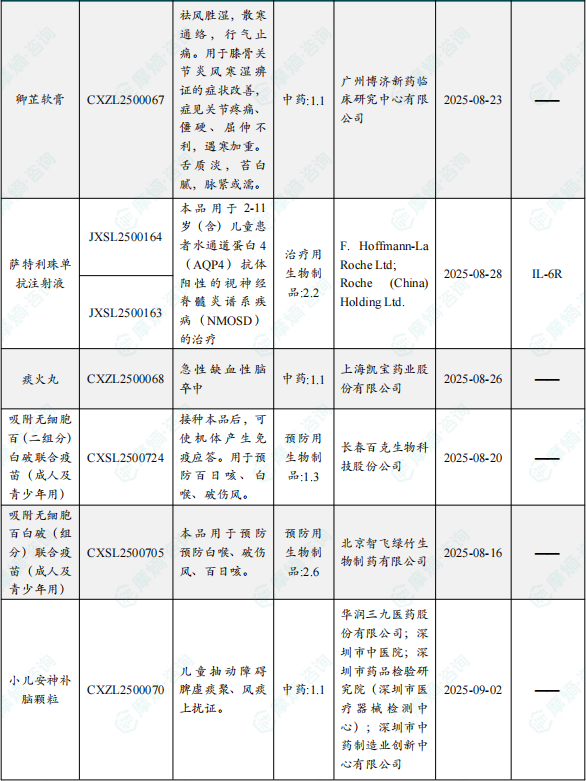
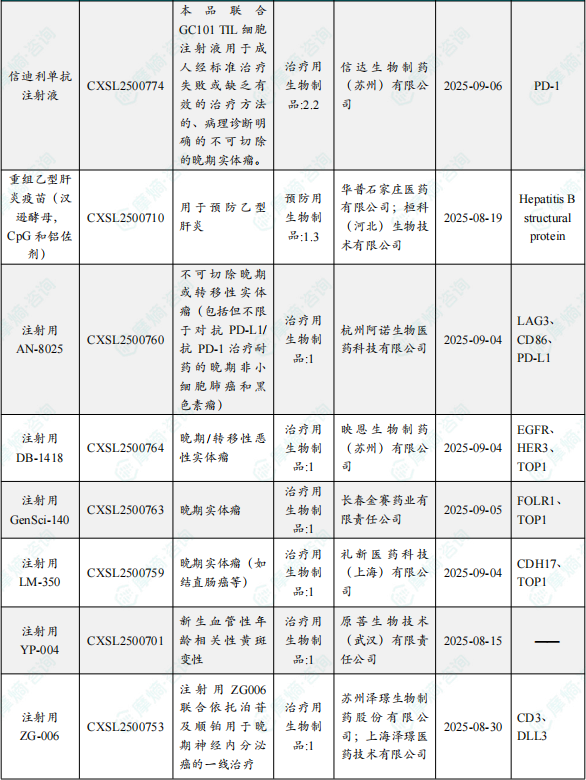
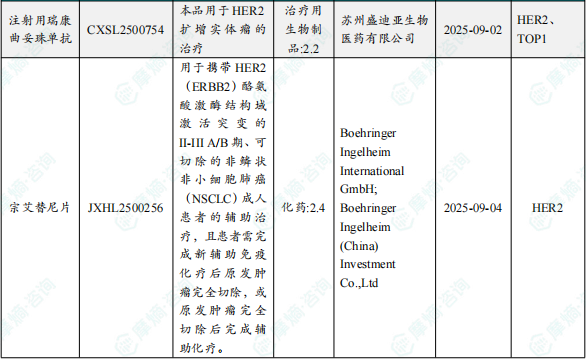
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本周获批上市创新药信息速览
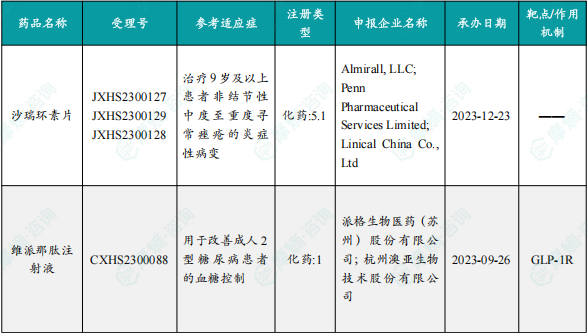
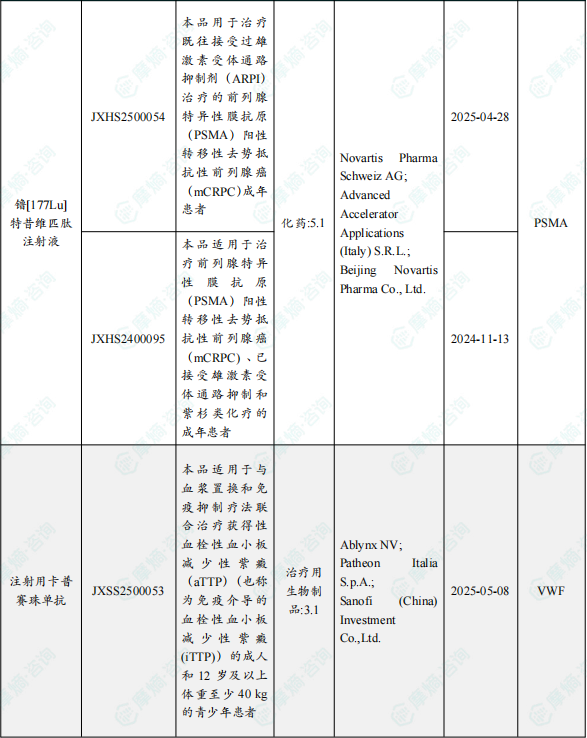
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵医药数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第46周11.10-11.16国内仿制药/生物类似物申报/审批数据分析
2. 2025年第46周11.10-11.16国内医药大健康行业政策法规汇总
3. 2025年第46周11.10-11.16全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.11.10-2025.11.16) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2025年第7周02.10-02.16国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第35周08.26-09.01国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
3. 2024年第33周08.12-08.18国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论