1.4.1 本周全球TOP10创新药研发进展
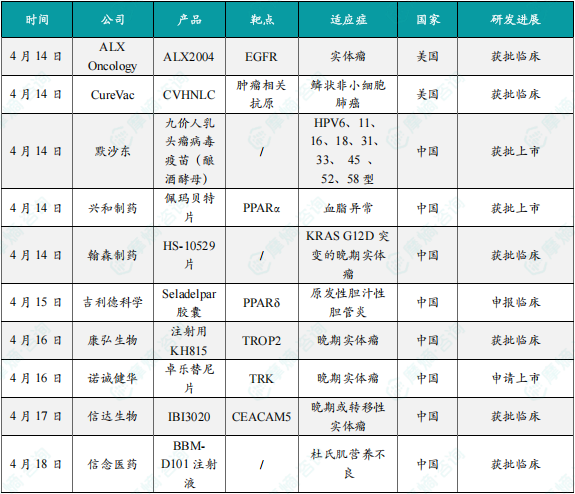
(1)ALX Oncology公司抗体偶联药物(ADC)ALX2004在美国获批临床,针对实体瘤
4月14日,ALX Oncology公司宣布,其针对EGFR表达实体瘤的潜在“best-in-class”及“first-in-class”抗体偶联药物(ADC)ALX2004 的IND申请已获FDA批准。ALX2004是通过该公司专有的拓扑异构酶I抑制剂有效载荷平台设计的,由三部分组成,分别是经优化的抗EGFR抗体骨架、稳定性增强的连接子,以及能产生强旁观者效应的专有拓扑异构酶I载荷,旨在克服早期EGFR靶向ADC因药物设计、脱靶毒性及传统载荷局限性导致的临床瓶颈。
(2)CureVac公司精准免疫疗法药物CVHNLC在美国获批临床,针对鳞状非小细胞肺癌
CureVac公司宣布,美国FDA已批准其基于mRNA的精准免疫疗法 CVHNLC 的IND申请,可启动针对鳞状非小细胞肺癌(sqNSCLC)患者的1期研究。CVHNLC 由两种编码8种在sqNSCLC中常见的肿瘤相关抗原(TAA)的mRNA构建体组成,其中4种为已知的实体瘤相关抗原,另4种为CureVac专有发现平台鉴定的新TAA。该疗法采用第二代mRNA骨架,使用未修饰的mRNA封装于脂质纳米颗粒(LNP)中。该公司计划将 CVHNLC 与免疫检查点抑制剂 pembrolizumab 联用进行临床试验,旨在放大靶向抗肿瘤免疫反应。
(3)默沙东九价HPV疫苗男性适应证在华获批上市
4月14日,默沙东宣布,佳达修9[九价人乳头瘤病毒疫苗(酿酒酵母)](后称“九价HPV疫苗”)多项新适应证已获得中国国家药品监督管理局(NMPA)的上市批准,适用于16~26岁男性接种。这一获批使佳达修9成为中国获批、可适用于适龄男性女性接种的九价HPV疫苗。佳达修9覆盖6、11、16、18、31、33、45、52 和 58 型,共九种HPV型别。此次获批的男性适应证可预防HPV16、18引起的肛门癌,HPV6和11引起的生殖器疣(尖锐湿疣),由HPV6、11、16、18引起的以下癌前病变或不典型病变:1级、2级、3级肛门上皮内瘤样病变(AIN)。
(4)兴和制药佩玛贝特片在中国获批上市,针对血脂异常
4月14日,中国国家药监局(NMPA)官网发布的批件信息显示,Kowa Company(兴和制药)公司研发的新药 佩玛贝特片 在中国正式获批,该药本次获批的适应症为治疗血脂异常。佩玛贝特是一种新型过氧化物酶体增殖物激活受体(PPAR)α激动剂。在作用机制上,它通过与PPARα结合并调节参与脂质代谢的基因的表达,从而降低血浆甘油三酯(TG)水平和提升高密度脂蛋白胆固醇(HDL-C)水平,以达到降脂的目的。
(5)翰森制药HS-10529片获批临床,针对KRAS G12D突变实体瘤
4月14日,中国国家药监局药品审评中心(CDE)官网公示,翰森制药申报的1类新药 HS-10529片 获批临床,拟开发治疗KRAS G12D突变的晚期实体瘤(胰腺癌、结直肠癌、非小细胞肺癌等)。KRAS是常见发生突变的驱动基因,KRAS G12D是KRAS突变中主要的突变亚型,在大约34%的胰腺导管腺癌、12%的结直肠癌和4%的非小细胞肺癌以及其它多种类型癌症中可检测出。KRAS G12D突变的患者预后不佳,且目前尚未有相关的靶向疗法获批上市。根据CDE官网及公开资料查询,本次为该产品首次在中国获批IND。
(6)吉利德seladelpar胶囊首次在中国申报临床
4月15日,中国国家药监局药品审评中心(CDE)官网公示,吉利德科学(Gilead Sciences)申报的 seladelpar胶囊 的临床试验申请获得受理。这是一种新型选择性过氧化物酶体增殖物激活受体δ(PPARδ)激动剂。该产品目前已经在美国、欧盟和英国获批,用于联合熊去氧胆酸治疗对熊去氧胆酸应答不佳或不耐受的原发性胆汁性胆管炎(PBC)患者。通过CDE官网查询可知,本次为该产品首次在中国申报IND。研究表明,PPARδ能够调节关键的代谢及肝病相关途径。临床前和临床数据表明,seladelpar具有抗胆汁淤积、抗炎、止痒及抗纤维化作用。该疗法原由CymaBay公司所研发,吉利德科学在2024年2月与该公司达成总额达43亿美元的收购协议,进而囊获这款疗法。
(7)康弘生物新药注射用KH815在中国获批临床,针对晚期实体瘤
4月16日,中国国家药监局药品审评中心(CDE)官网公示,康弘药业全资子公司康弘生物申报的1类新药 注射用KH815 获批临床,拟开发治疗晚期实体瘤。公开资料显示,这是康弘生物研发的一种具有抗耐药潜力的靶向滋养层细胞表面抗原2(TROP2)的新型双载荷(dual-payload)抗体偶联药物(ADC)。TROP2是一种广泛表达的糖蛋白抗原,可促进肿瘤细胞增殖、侵袭、转移扩散等过程,其高表达与肿瘤患者生存期缩短及不良预后密切相关。该产品于今年3月在澳大利亚获批1期临床研究。本次是该产品首次在中国获批临床。
(8)诺诚健华1类新药卓乐替尼片上市申请获得受理
4月16日,中国国家药监局药品审评中心(CDE)官网公示,诺诚健华申报的1类新药 卓乐替尼片 上市申请获得受理。这是该公司在研的第二代泛TRK抑制剂 zurletrectinib(ICP-723),本次申报上市的适应症为用于治疗携带NTRK融合基因的晚期实体瘤成人和青少年(12周岁≤年龄<18周岁)。Zurletrectinib 是第二代泛TRK抑制剂,拟开发用于治疗未接受过TRK抑制剂治疗,以及对第一代TRK抑制剂产生耐药的、携带NTRK融合基因的晚期或转移性实体瘤患者。与其他第二代药物相比,zurletrectinib 体内脑渗透性和颅内活性更强。该产品对野生型TRKA、TRKB和TRKC激酶,以及对耐药突变型TRKA G595R和TRKA G667C均展现出很强的抑制作用。研究人员认为,zurletrectinib 具有强大的颅内活性,可治疗NTRK基因融合阳性肿瘤,并克服第一代TRK抑制剂的获得性耐药。
(9)信达生物1类新药IBI3020获批临床,针对晚期或转移性实体瘤
4月17日,中国国家药监局药品审评中心(CDE)官网公示,信达生物申报的1类新药 IBI3020 获批临床,拟开发治疗不可切除、局部晚期或转移性实体瘤。根据公开资料,这是一款靶向CEACAM5的双载荷抗体偶联药物(ADC),本次是该产品首次在中国获批IND。IBI3020 是该公司基于差异化的下一代连接子-载荷技术平台研发,可特异性结合CEACAM5靶点。CEACAM5是一种糖蛋白,通常在癌胚胎的发展过程中表达,包括结直肠癌、非小细胞肺癌以及乳腺癌等,并在细胞迁移、细胞侵袭和细胞粘附中起关键作用。
(10)信念医药BBM-D101注射液获批临床,针对杜氏肌营养不良
4月18日,中国国家药监局药品审评中心(CDE)官网公示,信念医药在研的1类新药 BBM-D101注射液 获批临床,拟开发治疗杜氏肌营养不良(DMD)。BBM-D101注射液是一款腺相关病毒(AAV)基因治疗药物,通过单次静脉输注,基于工程化AAV载体,将优化的基因表达盒递送到全身肌肉,以期实现“一次给药、长期有效”地治疗DMD。本次是该产品首次在中国获批IND,本次获批的临床试验是一项开放、单次给药临床研究,旨在评估静脉输注 BBM-D101注射液 在4~9岁DMD男孩中的安全性和有效性,本次获批意味着该产品的临床研究进程迎来新的进展。
1.4.2 本周全球TOP10积极/失败临床结果

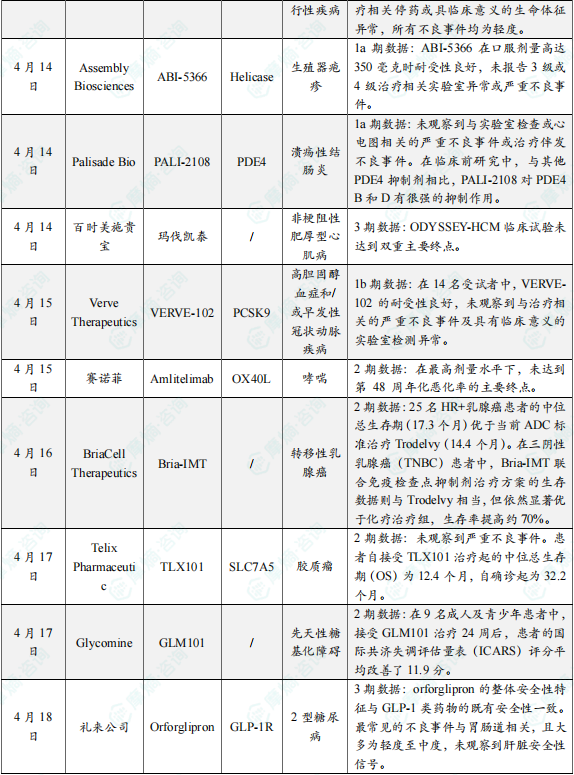
(1)Cerevance公司在研药物CVN293 1期临床结果积极
4月14日,Cerevance公司公布了其钾双孔结构域通道亚家族K成员13(KCNK13)抑制剂 CVN293 的积极1期临床试验结果。CVN293 是一种高选择性口服KCNK13抑制剂,旨在通过抑制神经炎症减缓神经退行性疾病进展,KCNK13是一种潜在的NLRP3炎性小体激活的新型调节因子。1期临床试验结果显示,接受CVN293单次和14天内多次给药的健康成人对该药物的耐受性良好,100%的受试者完成了试验,未出现剂量限制性毒性、治疗相关停药或具临床意义的生命体征异常,所有不良事件均为轻度。CVN293还显示出强大的脑渗透性,支持KCNK13抑制剂对以神经炎症为特征的神经退行性疾病的效用。
(2)Assembly Biosciences公司在研药物ABI-5366 1a期临床试验中期数据公布
4月14日,Assembly Biosciences公司公布了一种用于复发性生殖器疱疹的长效解旋酶-引物酶抑制剂 ABI-5366 的1a期临床试验数据。该候选疗法通过靶向病毒解旋酶-引物酶复合体发挥作用。这是一种在HSV-1和HSV-2中都保守的重要病毒酶复合体,并且宿主细胞中没有类似的酶复合体。在短期临床研究中,HSV解旋酶-引物酶抑制剂显示出比核苷类似物更佳的疗效潜力。1期临床试验结果显示,ABI-5366 在口服剂量高达350毫克时耐受性良好,未报告3级或4级治疗相关实验室异常或严重不良事件。此外,在所有剂量组中观察到 ABI-5366 的半衰期约为20天,有望实现每周一次或每月一次的口服给药方案。
(3)Palisade Bio公司在研药物PALI-2108 1a期临床试验数据公布
4月14日,Palisade Bio公司宣布,其用于治疗溃疡性结肠炎(UC)的在研药物 PALI-2108 已完成1a期临床试验,预计将于2025年5月底公布顶线数据。PALI-2108 是一种PDE4抑制剂前药,能在UC和FSCD等疾病部位局部活化,显著提升病变组织内PDE4抑制剂浓度,同时减少全身暴露,从而降低腹泻等传统PDE4抑制剂的副作用。初步结果显示,迄今为止未观察到与实验室检查或心电图相关的严重不良事件或治疗伴发不良事件。在临床前研究中,与其他PDE4抑制剂相比,PALI-2108对PDE4 B和D有很强的抑制作用。这些结果表明,在剂量相当的情况下,PALI-2108具有极佳的耐受性。
(4)百时美施贵宝在研药物玛伐凯泰3期研究失败,针对非梗阻性肥厚型心肌病
4月14日,百时美施贵宝宣布,一项评估 Camzyos(mavacamten,玛伐凯泰) 用于治疗纽约心脏协会 (NYHA) II-III级症状性非阻塞性肥厚型心肌病(nHCM)成年患者的3期ODYSSEY-HCM临床试验未达到双重主要终点。该研究是迄今为止在nHCM患者中完成的规模最大和持续时间最长的一项临床试验。ODYSSEY-HCM是一项随机、双盲、安慰剂对照3期临床试验,在全球范围内招募了580名患有症状性(NYHA II级或III级)非梗阻性肥厚型心肌病(nHCM)的成年患者,评估了玛伐凯泰对比安慰剂治疗有效性和安全性。结果显示,与安慰剂组相比,玛伐凯泰组在KCCQ-23 CSS评分和pVO2方面无显著改善。此外,研究中未观察到新的安全性信号。
(5)Verve Therapeutics公司在研药物VERVE-102 1b期临床结果积极
4月15日,Verve Therapeutics宣布了在研碱基编辑疗法 VERVE-102 在1b期临床试验Heart-2中的初步积极数据。这项临床试验的受试者包括杂合性家族性高胆固醇血症(HeFH)和/或早发性冠状动脉疾病(CAD)的患者,这两个人群均需要深度且持久地降低血液中的低密度脂蛋白胆固醇(LDL-C)水平。试验结果显示,在14名受试者中,VERVE-102 的耐受性良好,未观察到与治疗相关的严重不良事件(SAEs)及具有临床意义的实验室检测异常。单次输注 VERVE-102 可导致血液中PCSK9蛋白水平和LDL-C呈剂量依赖性下降,其中在0.6 mg/kg剂量组的4名受试者中,平均血液LDL-C降低53%,LDL-C降低幅度最高可达69%。VERVE-102 是一种在研体内碱基编辑药物,旨在通过单次治疗,永久性关闭肝脏中PCSK9基因的表达,从而持久性降低导致疾病的LDL-C。
(6)赛诺菲Amlitelimab 2期临床研究未达到主要终点
4月15日,赛诺菲公布了 Amlitelimab 治疗哮喘的2期TIDE-Asthma研究,患者在前24周每四周接受一次 Amlitelimab 治疗,在剩余的36周每12周接受一次治疗,直至第60周。主要终点是重度哮喘发作的年发生率,关键次要终点包括肺功能和哮喘控制。初步结果表明,在最高剂量水平下,未达到第 48 周年化恶化率的主要终点。但中等剂量组相比安慰剂组显示出“统计学显著且具有临床意义”的哮喘发作次数降低。另外,在60周时,高剂量组哮喘发作次数获得更显著的数值减少。在亚组分析中,赛诺菲特别指出 amlitelimab 在异质性炎症哮喘患者群体中展现出“令人信服的疗效”。公司声明称,若后续研究能验证这一发现,可能为这一长期缺乏有效疗法的患者群体带来突破性治疗方案。
(7)BriaCell Therapeutics公司癌症疫苗联合疗法2期试验积极结果公布
4月16日,BriaCell Therapeutics公司宣布,其在研癌症疫苗疗法 Bria-IMT 联合免疫检查点抑制剂(CPI)在2期临床研究中取得了积极生存期数据,在激素受体阳性(HR+)转移性乳腺癌(MBC)患者中显示出优于现有抗体药物偶联物药物(ADC)的疗效。在该公司针对晚期转移性乳腺癌的2期临床试验中,共有37名患者接受Bria-IMT治疗,其中25名被确认为HR+乳腺癌患者。分析显示,这25名患者的中位总生存期(17.3个月)优于当前ADC标准治疗Trodelvy(14.4个月)。在三阴性乳腺癌(TNBC)患者中,Bria-IMT联合免疫检查点抑制剂治疗方案的生存数据则与Trodelvy相当,但依然显著优于化疗治疗组,生存率提高约70%。截至目前,尚未报告因Bria-IMT导致的治疗中断事件。
(8)Telix Pharmaceuticals公司在研药物TLX101 2期临床试验结果积极
4月17日,Telix Pharmaceuticals公布,其LAT-1靶向放射性偶联药物(RDC)TLX101(131I-iodofalan)在IPAX-Linz临床2期研究中,在治疗复发性高级别胶质瘤(HGG)患者时取得初步积极结果。IPAX-Linz是一项单臂、研究者发起的试验,旨在评估TLX101联合体外放射治疗(EBRT)的安全性、耐受性及初步疗效。目标入组人群为首次或第二次复发的高级别胶质瘤患者,包括胶质母细胞瘤患者。研究结果显示,TLX101 具有良好的耐受性,未观察到严重不良事件。初步疗效数据令人鼓舞,患者自接受 TLX101 治疗起的中位总生存期(OS)为12.4个月,自确诊起为32.2个月。该结果与此前在IPAX-1临床1/2期研究中观察到的结果一致。过往研究显示,仅接受EBRT治疗的复发性胶质母细胞瘤患者的中位OS为9.9个月。
(9)Glycomine在研药物GLM101 2期开放标签研究数据公布
4月17日,Glycomine宣布完成1.15亿美元C轮融资,所获得资金将用于推进其主打药物 GLM101 进入2b期临床试验。GLM101 是一款潜在“first-in-class”的甘露糖-1-磷酸替代疗法,正在开发用于治疗磷酸甘露糖变位酶2相关性先天性糖基化障碍 (PMM2-CDG)。这是一种罕见且危及生命的遗传性疾病,目前尚无已批准的治疗方法。Glycomine已在欧洲和美国招募了20余名患者参与其进行中的2期研究,并已在儿科患者中启动给药。进行中的2期开放标签研究的数据表明,GLM101 在改善共济失调方面展现出积极效果。共济失调是PMM2-CDG最具代表性的致残表现。在9名成人及青少年患者中,接受 GLM101 治疗24周后,患者的国际共济失调评估量表(ICARS)评分平均改善了11.9分。
(10)礼来公司在研药物Orforglipron 3期临床试验结果积极
4月18日,礼来公司(Eli Lilly and Company)公布了其在研口服小分子胰高血糖素样肽-1(GLP-1)受体激动剂 orforglipron 的首个3期临床试验结果。Orforglipron 是一种在研、每日一次的小分子(非肽类)口服GLP-1受体激动剂,可在全天任何时间服用,无需饮食或饮水方面的限制。Orforglipron 由中外制药株式会社(Chugai Pharmaceutical)发现,并于2018年授权给礼来公司。中外与礼来联合发表了该分子的前期药理学研究数据。临床试验数据显示,该药物在血糖控制、体重管理及安全性方面展现出与注射型GLP-1药物相当的疗效。具体而言,orforglipron 可在不同剂量下将2型糖尿病成人患者的糖化血红蛋白(A1C)平均降低1.3至1.6个百分点;在最高剂量组中,患者平均体重减轻达16.0磅(7.9%)。根据资料显示,orforglipron 是首个完成3期临床试验的口服小分子GLP-1受体激动剂,标志着GLP-1药物开发的又一重要突破。
同期事件:
1. 2025年第16周04.14-04.20国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第16周04.14-04.20国内仿制药/生物类似物申报/审批数据分析
3. 2025年第16周04.14-04.20国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.04.14-2025.04.20) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论