1.1.1 总体概况
根据摩熵医药数据库统计,2025.04.14-2025.04.20期间共有62个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号44个,进口药品受理号18个。
本周共计52款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药16款,生物药32款,中药4款。其中值得注意的有:
(1)Bexicaserin口服溶液
4月17日,CDE官网公示:Longboard制药公司的Bexicaserin口服溶液获得临床试验默示许可,用于治疗发育性癫痫性脑病(DEE)。公开资料显示,Bexicaserin口服溶液是一种口服的中枢作用型5-HT2C超激动剂,旨在通过调节GABA来抑制癫痫发作时的中枢兴奋过度。且该药物对5-HT2B和5-HT2A受体亚型没有可检测的活性,这减少了潜在的副作用和不良反应。
(2)HWS-116注射液
4月17日,CDE官网公示:人福医药的HWS-116注射液获得临床试验默示许可,用于治疗晚期实体瘤。公开资料显示,HWS-116注射液是一款靶向FGFR2b的人源化单克隆抗体,通过阻断成纤维细胞生长因子受体介导的信号通路抑制肿瘤生长,并通过其Fc介导的抗体依赖性细胞介导的细胞毒性作用(ADCC)和吞噬作用(ADCP)杀伤肿瘤细胞。
(3)BBM-D101注射液
4月18日,CDE官网公示:信念医药的BBM-D101注射液获得临床试验默示许可,用于治疗杜氏肌营养不良(DMD)。公开资料显示,BBM-D101注射液是一款腺相关病毒(AAV)基因治疗药物,可通过单次静脉输注,基于工程化AAV载体,将优化的基因表达盒递送到全身肌肉,以期实现“一次给药、长期有效”地治疗DMD。
本周共2款新药获批上市,即波哌达可基注射液和佩玛贝特片。
4月14日,国家药监局发布药品批准证明文件送达信息:信念医药的波哌达可基注射液获批上市,用于治疗中重度血友病b(先天性凝血因子ix缺乏症)成年患者。公开资料显示,是重组腺相关病毒(raav)载体基因治疗产品,通过raav载体将fix基因导入靶细胞(主要是肝细胞),从而表达fix。
4月14日,国家药监局发布药品批准证明文件送达信息:日本兴和株式会社的佩玛贝特片获批上市,用于治疗高脂血症(包括家族性高脂血症)。公开资料显示,佩玛贝特片是一种新型、高选择性的过氧化物酶体增殖物激活受体α(PPARα)调节剂,通过与PPARα结合并调节参与脂质代谢的基因表达,显著改善血脂代谢。它能有效降低血浆甘油三酯(TG)水平(可达50%),同时增加高密度脂蛋白胆固醇(HDL-C)水平,并对其他血脂指标产生积极影响。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
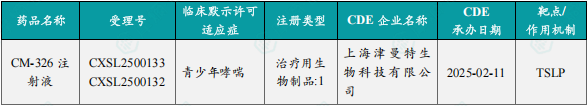
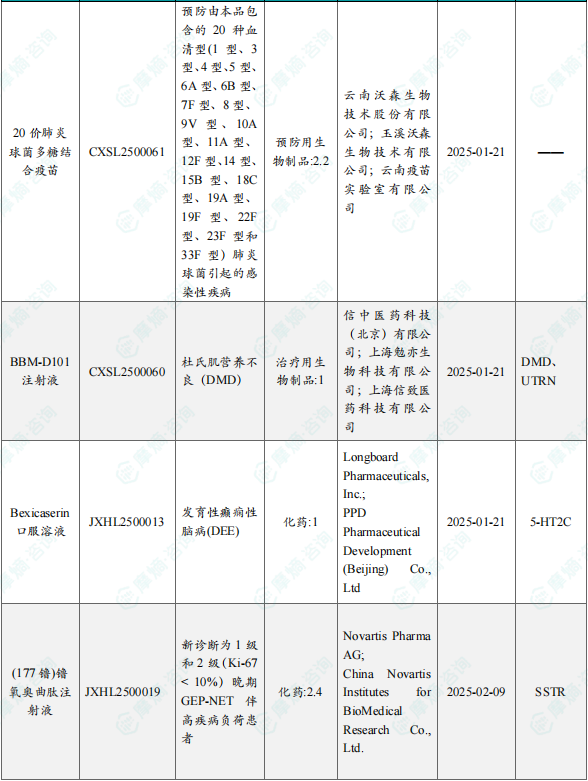
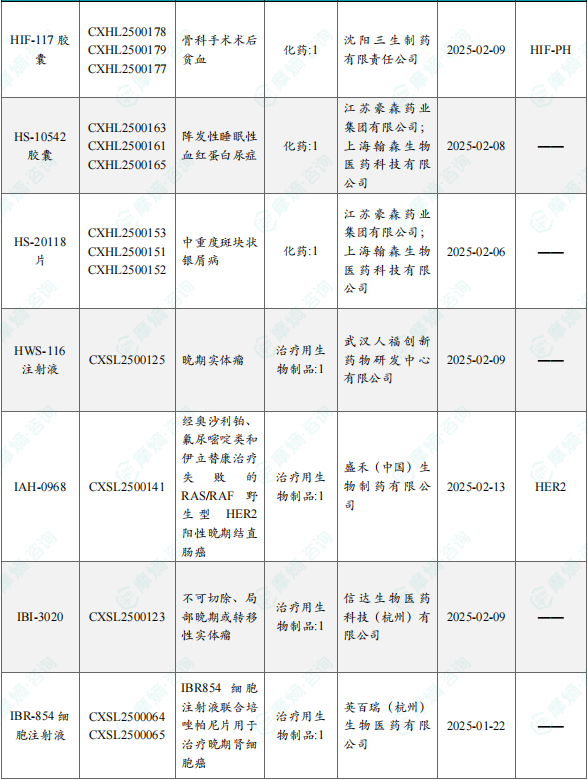
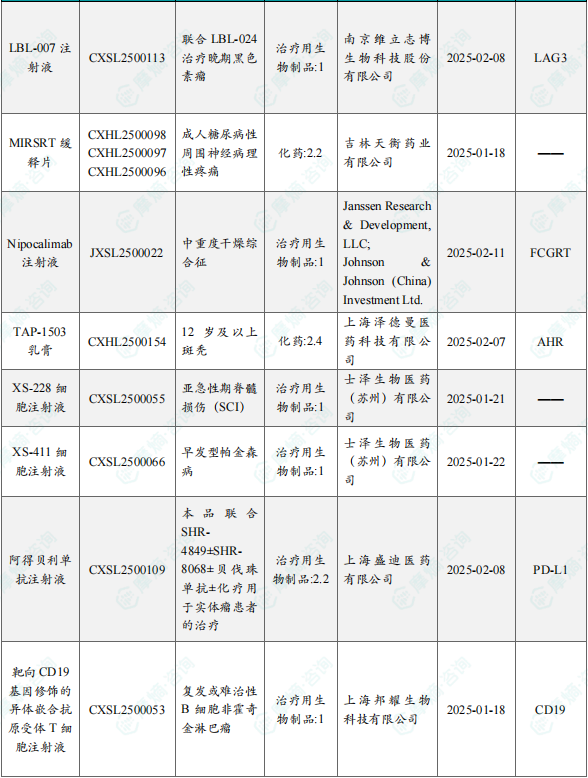

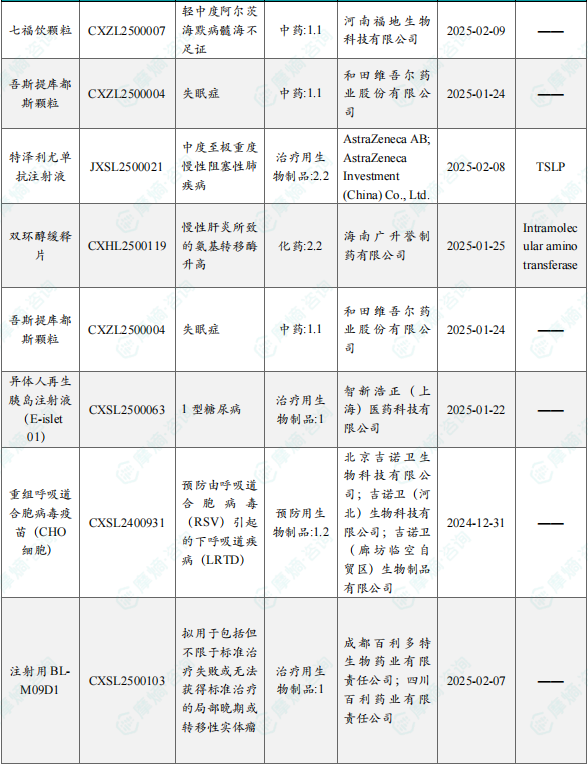
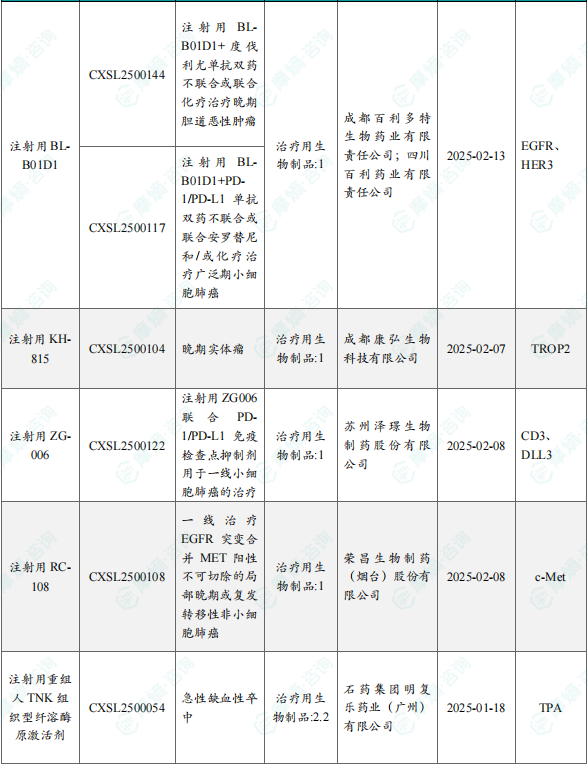
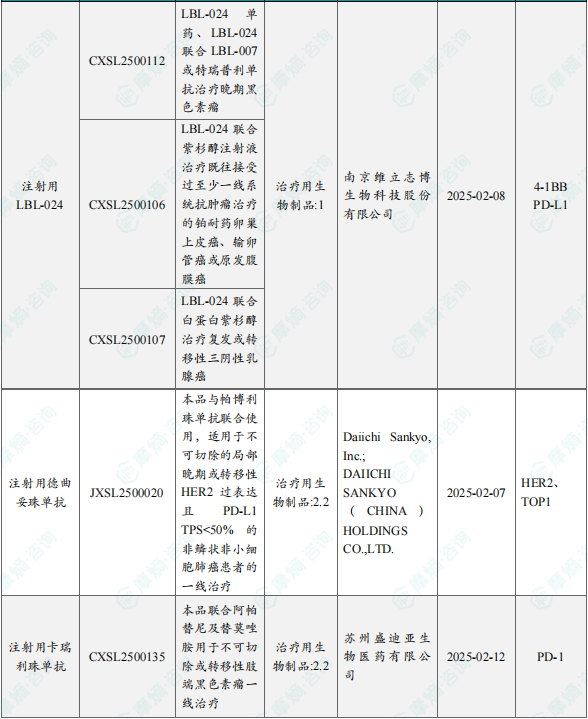
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本周获批上市创新药信息速览
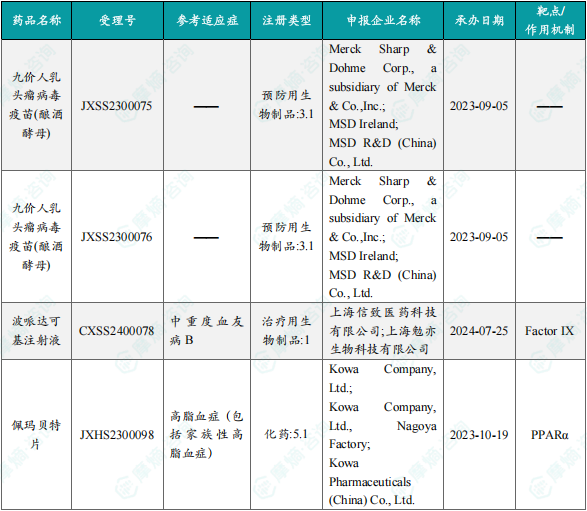
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵医药数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第16周04.14-04.20国内仿制药/生物类似物申报/审批数据分析
2. 2025年第16周04.14-04.20国内医药大健康行业政策法规汇总
3. 2025年第16周04.14-04.20全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.04.14-2025.04.20) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论