
急性髓系白血病(AML)是一种起源于造血干细胞的恶性克隆性疾病,以其高度的异质性和侵袭性称,长期以来是血液系统恶性肿瘤治疗领域的一大挑战。
在AML的众多分子亚型中,FMS样酪氨酸激酶3内部串联重复突变阳性AML(FLT3-ITD AML)尤为凶险。该突变导致FLT3受体持续激活,驱动白血病细胞无节制增殖,并与高复发率、短生存期紧密相关。传统化疗方案对此类患者的疗效有限,临床迫切需要能够精准打击这一驱动基因的靶向药物。
在这样的背景下,Quizartinib作为一种高效、高选择性的第二代FLT3抑制剂应运而生。本文将系统性地梳理Quizartinib的作用机制、关键临床试验数据、临床应用现状及其在AML治疗格局中定位与未来展望。
一、Quizartinib的机制原理,精准锁定FLT3-ITD突变
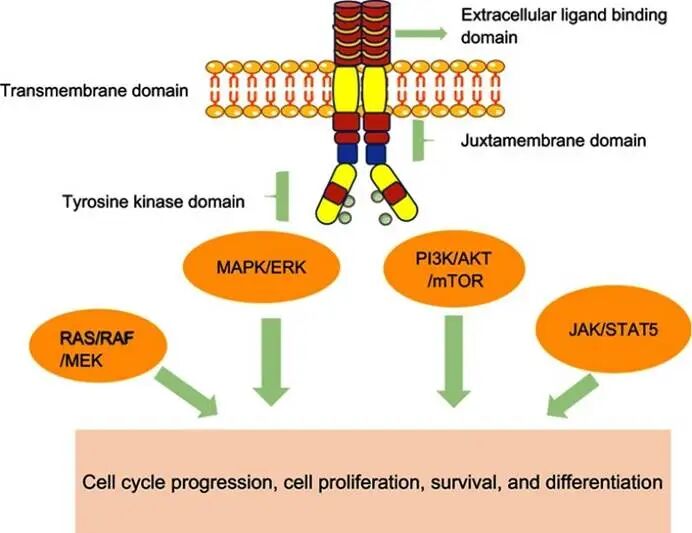
FLT3是一种III型受体酪氨酸激酶,在正常造血干细胞的增殖、分化和存活中扮演着关键角色。当其配体FL结合后,受体发生二聚化并激活下游的信号通路,如STAT5、RAS/MAPK和PI3K/AKT,从而精确调控造血过程。然而,在约25%的AML患者中,FLT3基因发生了内部串联重复突变。这种突变使得FLT3受体无需配体结合即可自发形成二聚体,导致其激酶结构域被持续磷酸化,下游信号通路被异常、永久地激活。这种组成性激活状态,为白血病细胞提供了强大的生存和增殖信号,使其更具侵袭性,并对传统化疗产生耐药。Quizartinib正是针对这一核心致病机制而设计的精准武器。它属于II型FLT3抑制剂,其作用机制具有鲜明的特点,具体如下:
1.1 高度选择性
与第一代FLT3抑制剂相比,Quizartinib对FLT3-ITD突变型激酶的抑制活性(IC50值在皮摩尔级别)远高于对野生型FLT3的抑制活性,这意味着它能更精准地攻击携带突变癌细胞,而对正常造血细胞的“误伤”相对较小,从而在理论上降低了脱靶效应带来的毒性。
图1. FLT3基因编码的蛋白质结构及由FLT3受体激活启动的相关途径
1.2 独特的结合模式
II型抑制剂的特点是靶向FLT3激酶的非活性构象,即DFG-out构象。Quizartinib与ATP结合口袋内的这个特定构象结合,从而稳定激酶的非活性状态,有效阻断ATP的结合和底物的磷酸化,从源头上切断下游致癌信号的传导。这种独特的结合模式不仅赋予了其高效性,也决定了其耐药谱系与I型抑制剂(如Gilteritinib,靶向活性构象)有所不同。
1.3 强效的信号阻断
通过抑制FLT3-ITD的活性,Quizartinib能够有效抑制STAT5、MAPK和PI3K/AKT等关键下游信号通路的磷酸化,从而诱导白血病细胞凋亡(程序性死亡)、抑制其增殖并促进分化。在临床前模型中,Quizartinib展现出了对FLT3-ITD AML细胞强大的体外和体内抗肿瘤活性。
二、临床试验结果,从探索到验证的曲折征程
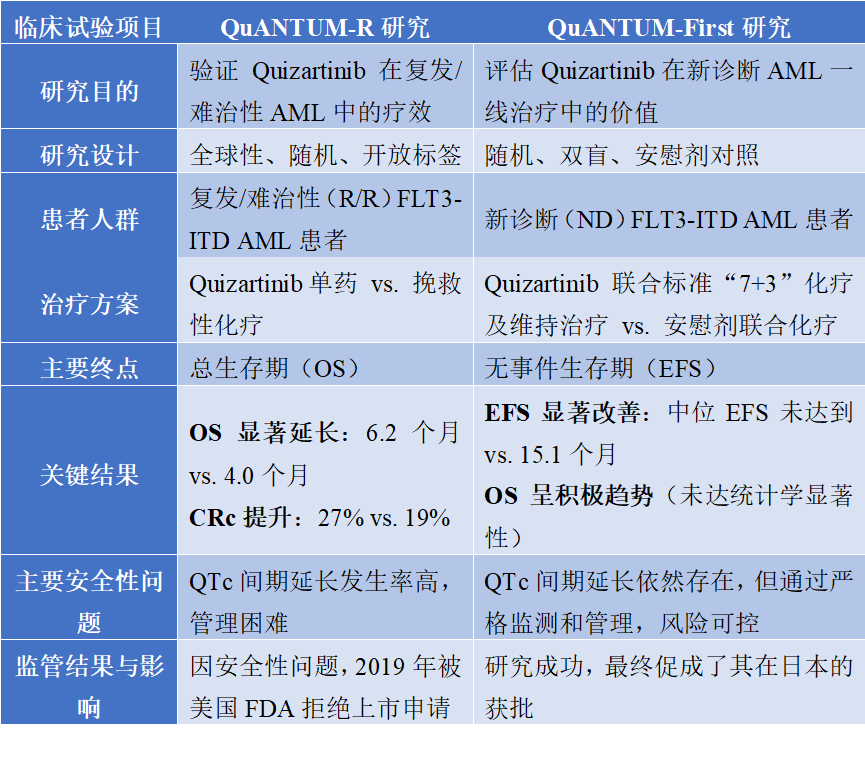
Quizartinib的临床开发之路并非一帆风顺,其关键性III期临床试验QuANTUM-R和QuANTUM-First的结果,共同塑造了它今天的临床地位和监管命运。
首先,在复发/难治性(R/R)AML领域,QuANTUM-R研究作为首个在R/R FLT3-ITD AML人群中显示出生存优势的FLT3抑制剂III期研究,证实了Quizartinib单药疗法的价值。该研究纳入367名患者,结果显示其中位总生存期(OS)显著延长至6.2个月(化疗组为4.0个月),复合完全缓解率(CRc)也提升至27%。然而,其突出的安全性问题,特别是QTc间期延长所带来的致命性心律失常风险,成为了监管审批的主要障碍,导致美国FDA在2019年因其获益-风险比问题而拒绝了其新药上市申请,使其在欧美市场的商业化进程陷入停滞。
为了突破困境并探索更前线的治疗潜力,研究人员启动了QuANTUM-First研究,将Quizartinib推向新诊断(ND)AML的一线治疗。这项随机、双盲、安慰剂对照的III期临床试验,评估了Quizartinib联合标准“7+3”化疗并后续进行单药维持治疗的疗效。研究成功达到主要终点,与安慰剂组相比,Quizartinib组患者的无事件生存期(EFS)得到显著改善(中位EFS未达到vs. 15.1个月)。尽管总生存期(OS)的改善未达到统计学显著性,但数据呈现出明确的积极趋势。更重要的是,在联合化疗和维持治疗的背景下,通过严格的心电图监测和剂量调整,QTc间期延长的风险被认为是可控的。QuANTUM-First研究的成功为Quizartinib开辟了新的应用道路,并最终促成了其在日本的获批。
表1. Quizartinib关键性III期临床试验对比
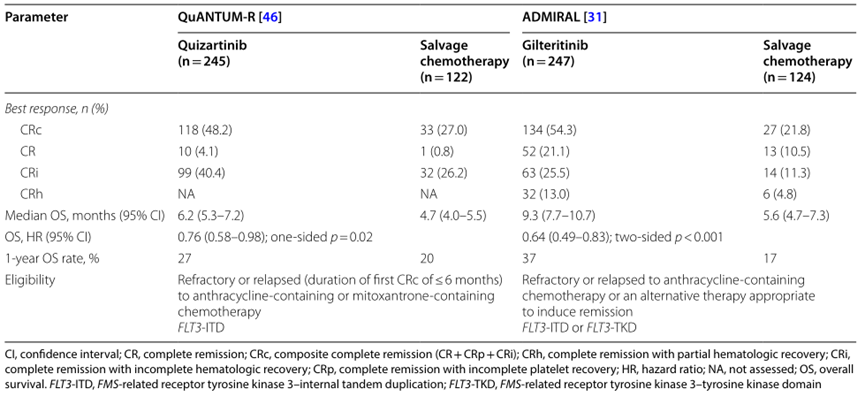
此外,QuANTUM-R和ADMIRAL临床研究还评估了 Quizartinib 和 Gilteritinib 在治疗FLT3-ITD阳性和FLT3突变 (包括ITD和TKD) 阳性的复发/难治性(R/R)AML患者中的疗效。研究结果显示,两种药物均显著提高了患者的总生存期,其中 Quizartinib 在FLT3-ITD阳性患者中展现出更大的优势。
虽然直接比较两种药物的疗效存在挑战,但与安慰剂相比,Quizartinib 和 Gilteritinib 均可延长患者达到CR的持续时间并降低复发风险。然而,Quizartinib 治疗组的不良事件发生率,尤其是中性粒细胞减少症和肺炎等感染的发生率,高于 Gilteritinib 治疗组。
表2. QuANTUM-R和ADMIRAL临床研究的疗效对比
三、临床应用与适应症现状,区域性成功与全球性挑战
Quizartinib的临床应用现状呈现出明显的区域性差异,这直接反映了不同国家药品监管机构对其获益-风险比的不同评估。
3.1 日本市场的率先批准
基于QuANTUM-R和QuANTUM-First研究的积极数据,日本厚生劳动省(MHLW)批准了Quizartinib用于治疗FLT3-ITD阳性的AML患者,具体适应症包括:
- 复发/难治性AML:作为单药疗法。
- 新诊断AML:与标准细胞毒性化疗联合用于诱导和巩固治疗,随后作为单药进行维持治疗。
日本的成功获批,标志着 Quizartinib 成为全球首个获批用于FLT3-ITD AML一线维持治疗的FLT3抑制剂,为其在该领域的临床价值提供了官方背书。在临床实践中,这意味着新诊断的FLT3-ITD AML患者可以在接受化疗后,通过Quizartinib维持治疗来进一步清除微小残留病(MRD),降低复发风险,从而争取长期生存。
3.2 欧美市场的监管困境
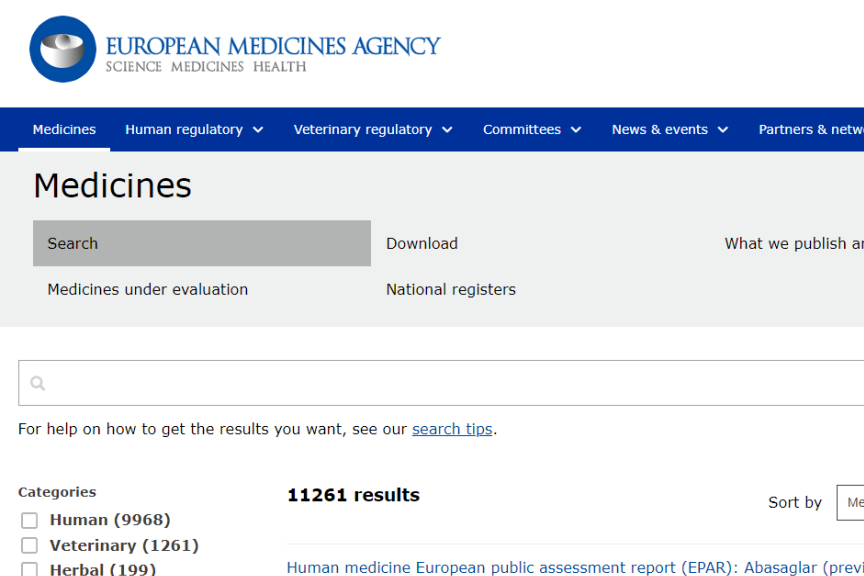
与日本形成鲜明对比的是,Quizartinib 在美国和欧洲市场却一波三折。美国食品药品监督管理局(FDA)在2019年发布的完整回复函(CRL)中,主要担忧点集中在QuANTUM-R研究中观察到的QTc间期延长相关的心血管风险,认为其安全性管理方案需要进一步优化。2023年7月, FDA批准奎扎替尼联合标准化疗,以及作为巩固化疗后的维持性单药疗法,用于治疗经FDA批准检测方法证实带有FLT3-ITD突变阳性的新确诊急性髓系白血病(AML)成人患者。此外,欧洲药品管理局(EMA)仍对 Quizartinib 持审慎态度。
图2. 美国批准的首个FLT3抑制剂,专门用于新诊断的FLT3-ITD阳性AML患者

3.3 在中国的上市申请已获得受理
目前,Quizartinib 尚未在中国获批上市。2025年1月18日,中国国家药监局药品审评中心(CDE)官网显示,第一三共申报的5.1类新药盐酸奎扎替尼片的上市申请已获得受理,用于治疗带有FLT3-ITD突变阳性的新确诊急性髓系白血病(AML)成人患者。但目前该药仍处于上市申请审核阶段,尚未正式获批。其适应症为FLT3-ITD突变阳性的新诊断AML成人患者,可联合标准阿糖胞苷和蒽环类药物用于诱导和巩固化疗,并作为巩固后的单药维持治疗。
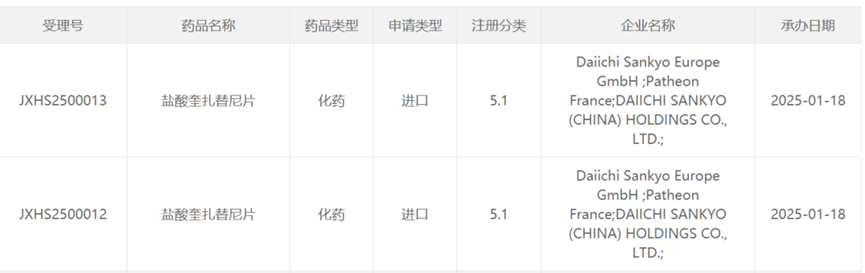

图3. 中国药物临床试验登记与信息公示平台官网
3.4 临床应用的核心考量
无论在哪个市场,Quizartinib的应用都严格依赖于两个核心前提:
- 精准的分子诊断:使用经过验证的检测方法确认患者存在FLT3-ITD突变是使用Quizartinib的先决条件。此外,FLT3-ITD等位基因比率(AR)的高低也与预后相关,可能影响治疗决策。
- 严密的安全性管理:QTc间期延长是临床应用中必须正视的风险。管理策略包括:治疗前进行基线心电图和电解质评估;治疗期间定期监测心电图;纠正低钾、低镁等电解质紊乱;避免与其他可能延长QTc间期的药物联用;根据QTc延长的程度及时进行剂量调整或中断治疗。
四、总结
总的来说,Quizartinib 的研发历程是现代肿瘤精准医疗的缩影,它以其对FLT3-ITD突变的高效抑制和明确的临床获益,特别是通过QuANTUM-First研究开创了AML一线维持治疗新模式,证明了精准打击的价值;然而,其因QTc间期延长问题在欧美市场遭遇的监管挫折,也深刻揭示了靶向药物研发中疗效与安全性平衡的核心挑战。尽管其全球市场前景尚存不确定性,但Quizartinib作为AML靶向治疗领域的重要探索者,可为该领域积累了宝贵的经验教训,持续激励着后续研发,从而为攻克白血病带来了新的希望!
参考文献:
[1] Cortes J. Quizartinib: a potent and selective FLT3 inhibitor for the treatment of patients with FLT3-ITD-positive AML. J Hematol Oncol. 2024 Nov 13;17(1):111. doi: 10.1186/s13045-024-01617-7.
[2] Naqvi K, Ravandi F. FLT3 inhibitor quizartinib (AC220). Leuk Lymphoma. 2019 Aug;60(8):1866-1876. doi: 10.1080/10428194.2019.1602263.
[3] Zhou F, Ge Z, Chen B. Quizartinib (AC220): a promising option for acute myeloid leukemia. Drug Des Devel Ther. 2019 Apr 8;13:1117-1125. doi: 10.2147/DDDT.S198950.
[4] 中国国家药监局药品审评中心官网.Retrieved Jan 18, 2025, from https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
[5] VANFLYTA® First FLT3 Inhibitor Approved in the U.S. Specifically for Patients with Newly Diagnosed FLT3-ITD Positive AML. Retrieved July 21, 2023 from https://www.daiichisankyo.com/files/news/pressrelease/pdf/202307/20230720_E.pdf
扩展阅读:
1. 以Rentosertib为例浅析AI制药:挑战“双十定律”,临床疗效初显锋芒
2. 口服大分子递送:技术、临床开发、药监、知识产权和商业化的全盘分析
3. 胰岛素深度剖析:一反常态,胰岛素逆势降价,背后的推手究竟是谁?
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论