
上周五(10月17日),第九十九批参比制剂征求意见稿公布。
19个参比未通过遴选,1个被调出参比,且再次出现了以:“拟申请参比制为附条件批准上市,审议未通过”的原因,而这已经不是第一次出现了。

附条件批准情况在FDA十分常见。盐酸阿曲生坦片批准信显示,该药品于2025年4月2日基于替代终点(降低蛋白尿) 通过加速批准途径获批,其完全批准仍取决于正在进行的确证性临床试验,预计2026年完成。
从结果来看,国内对参比遴选的态度似乎越来越谨慎,理由也愈发细化。
结合近期奥贝胆酸事件来看,附条件批准确实存在一定风险,奥贝胆酸片原研一直是附条件批准,最终因临床试验证明获益小于风险而撤市,国内一批仿制企业的巨额投入由此打了水漂。因此,CDE开始对这类原研的参比资格只会更加谨慎。
仿制药好品种越来越少,参比制剂的数量也一批比一批少,立项的窗口正一点点被关上。如今附条件批准品种若也不可选,未来立项难度只会更高。
在这样的背景下,国产创新药开始进入仿制企业的视野。
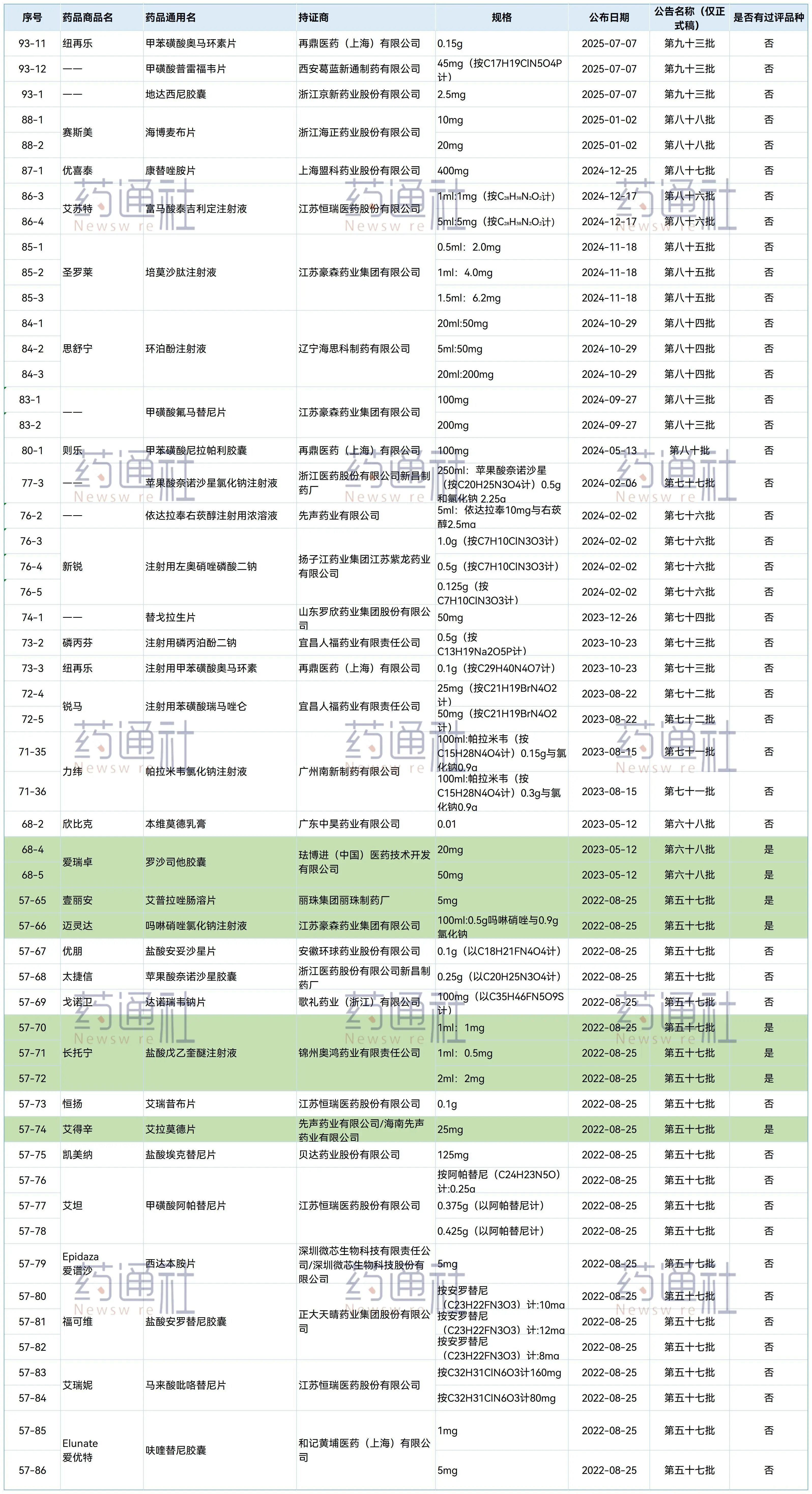
9月13日,美诺华的艾拉莫德片上市申请获CDE受理,这已经是该品种的第35家仿制企业。

一个国产新药被35家企业仿制,这在过去几乎没有先例。
此前的仿制热门大多来自外资原研大药,而国产创新药能被卷入这样规模的竞争,艾拉莫德可能是目前唯一的例子。
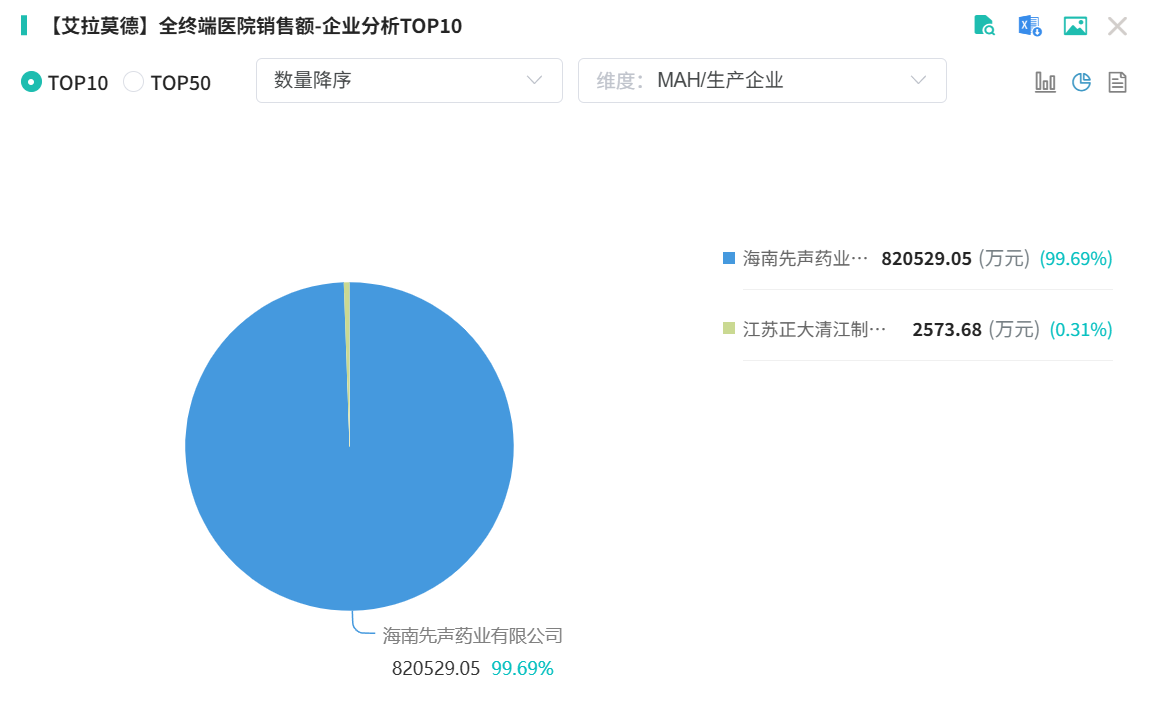
艾拉莫德片是一种抗炎、镇痛的小分子抗风湿性关节炎药物,由天津药物研究院与先声药业在2003年合作研发,2011年8月以1.1类新药获批上市(商品名“艾得辛”)。这是全球首个获批的艾拉莫德药物,也是近十年来国内唯一获批上市的小分子DMARD。
2017年进入国家医保目录,自此市场规模快速扩大。2022年艾拉莫德片院内销售额首次突破10亿元,此后一路飙升,2024年超17亿元,成为抗炎药和抗风湿药市场的TOP2产品。
而进入2025年,仅两季度,艾拉莫德片销售额就已超10亿,大概率今年还将再创新高。






















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论