
2025年04月14日,NMPA官网公示,日本兴和制药研发的新型口服降脂药物——佩玛贝特片(商品名:Parmodia)在中国获批上市,用于治疗高脂血症(包括家族性高脂血症)。




2025年04月14日,NMPA官网公示,日本兴和制药研发的新型口服降脂药物——佩玛贝特片(商品名:Parmodia)在中国获批上市,用于治疗高脂血症(包括家族性高脂血症)。
| 企业名称 | 申报临床 | 批准临床 | 申请上市 | 批准上市 | 一致性评价 |
|---|
佩玛贝特片于2017年在日本获批用于高脂血症治疗,中国属于第二个获批上市的国家。
佩玛贝特片是降血脂药物的“新星”,降脂类药物不论是贝特类还是他汀类,都有肝损伤和易出现横纹肌溶解症这两大副作用,服药期间需要定期监测。佩玛贝特片是高选择性激活PPAR-α,减少对其他受体的交叉作用,降低副作用风险。据现有数据看,佩玛贝特疗效与非诺贝特相当,副作用发生率却低很多。
我国的抗高血脂药物有200亿以上市场,目前是他汀类药物占据大头,若无其他强不良反应被发现,佩玛贝特片就是优质的新一代降脂药物。然而佩玛贝特片如此受研发端关注,不仅因为它优秀的临床数据,还因为它是行业预定的下一款“布瑞哌唑片”。
同样是日本研发,同样是新一代某治疗领域产品,同样是原研尚未在国内上市,国内完成BE试验的企业就达到了十几家。
又一款进口产品刚在国内上市,就被国内仿制企业“围剿”的品种!
佩玛贝特片刚刚上市,经查已完成BE试验的国内企业有12家,进行中9家,合计21家,正大天晴、科伦、桂林南药等均已完成。这就是等着原研上市好迅速提交上市申请,仿制企业的上市申请资料估计都备齐了,首仿之争一触即发。
让我们先来看一下前一代布瑞哌唑片是如何被全方面“围剿”的。
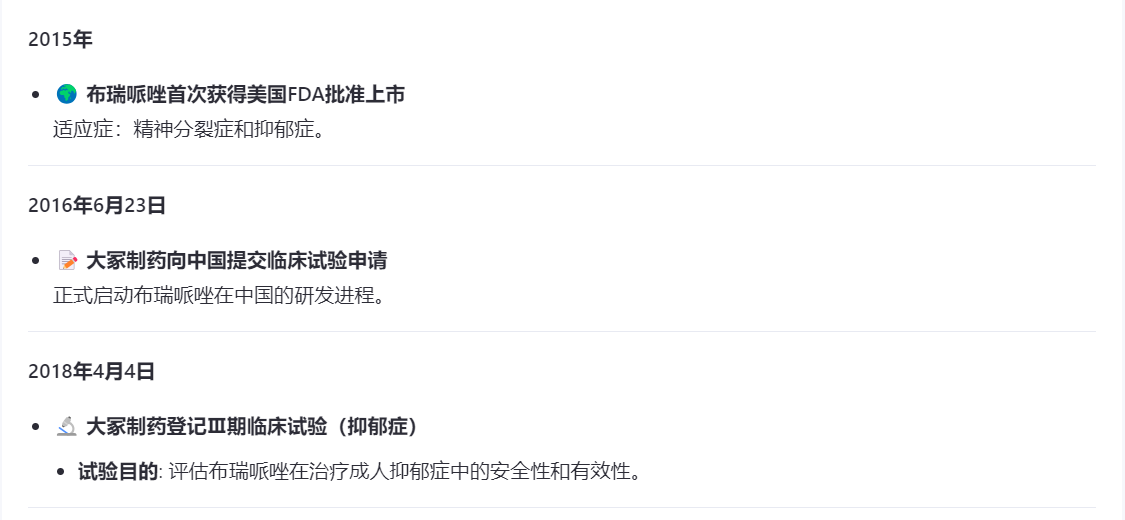
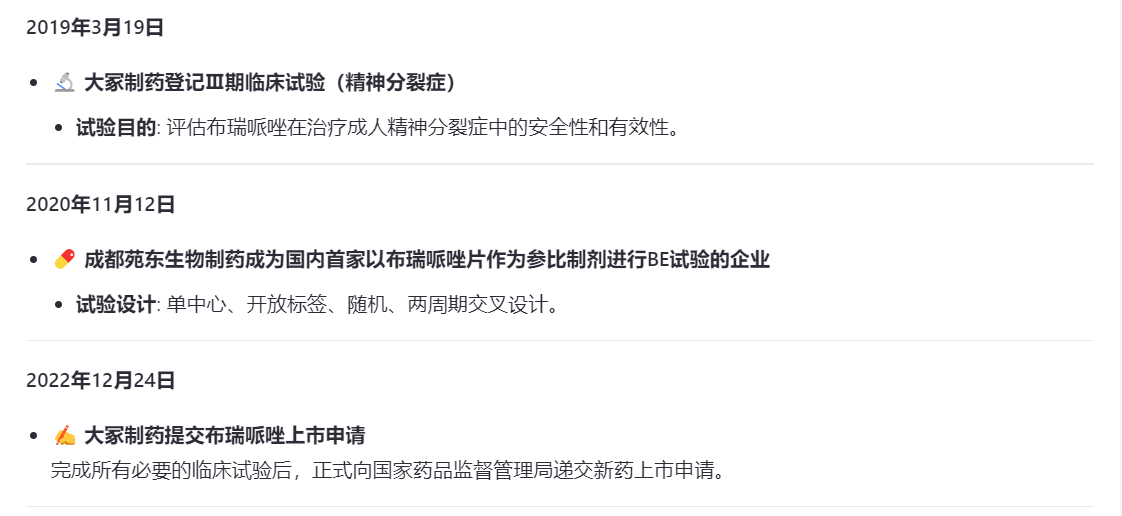
布瑞哌唑片由大冢制药研发,是第三代抗精神病类药物,优势在于不良反应和停药率更低。布瑞哌唑片上市,大冢制药花了接近十年时间,2016年申请临床试验,2018年开始进行布瑞哌唑片两大适应症的Ⅲ期临床试验,2022年提交上市,2024年获批。
在大冢制药登记Ⅲ期临床试验两年后,成都苑东首次使用布瑞哌唑片作为对照品,登记了BE试验。这个时间,大冢制药的Ⅲ期临床试验尚且在进行中。

截图来源:摩熵医药数据库
在成都苑东登记之后之后,齐鲁、科伦、扬子江纷纷开始进行布瑞哌唑片的BE试验。
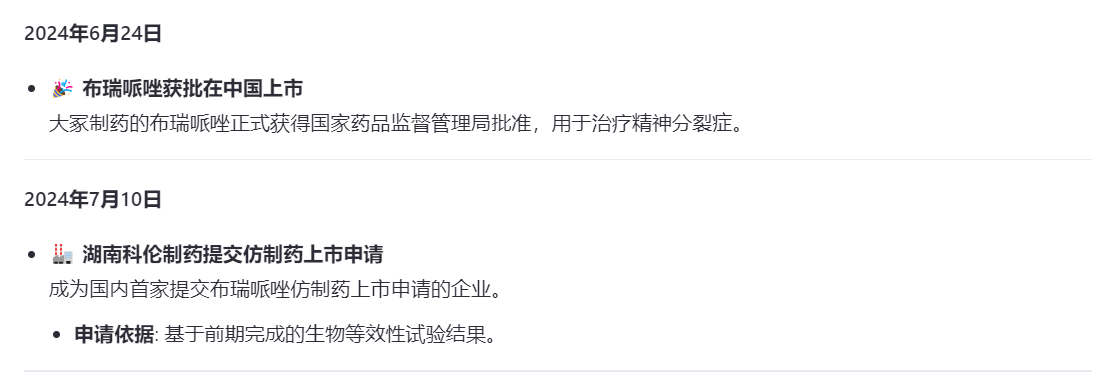
2024年6月25日,大冢制药旗下布瑞哌唑片(商品名:锐思定)在国内获批上市,用于治疗“精神分裂症”。
十五天后的7月10日,湖北科伦就提交了4类仿制申请,后续企业纷纷跟进,截至目前布瑞哌唑片已有34家企业提交了仿制上市申请,还有十几家企业在进行BE试验,以目前的申报进度,布瑞哌唑片最终竞争企业将突破四十家!
| 企业名称 | 申报临床 | 批准临床 | 申请上市 | 批准上市 | 一致性评价 |
|---|
仔细去查一下数据,以锐思定上市时间为节点,国内就有16家企业完成了BE试验,就等着原研获批上市。把这些时间放在一起对比更直观一点:
布瑞哌唑片的核心专利在2026年4月就会到期,而不出意外布瑞哌唑片的首仿2025年下半年就会出现,供大冢制药布局国内市场的时间只有短短不到两年。
这种瞄准法,就是为了避免品种进行验证性临床试验,原研未在国内上市,国内只能以化药3类仿制,可能需要进行临床安全性有效性试验,但如果原研已在国内顺利上市,那么就意味着安全性和有效性均已得到证实,大概率只需要完成BE试验就可以上市。
为了免去验证性临床,诸多企业在看到原研布局进口国内时就会先一步完成BE试验,就等着原研正式获批的那一天。
回归到佩玛贝特片来看,日本兴和制药2020年12月14日获得临床批件,2021年10月9日-2023年1月18日完成Ⅲ期试验,2025年4月14日获批上市,也是花了四年多的时间。
国内首家进行布局佩玛贝特片BE试验的企业及日期是:
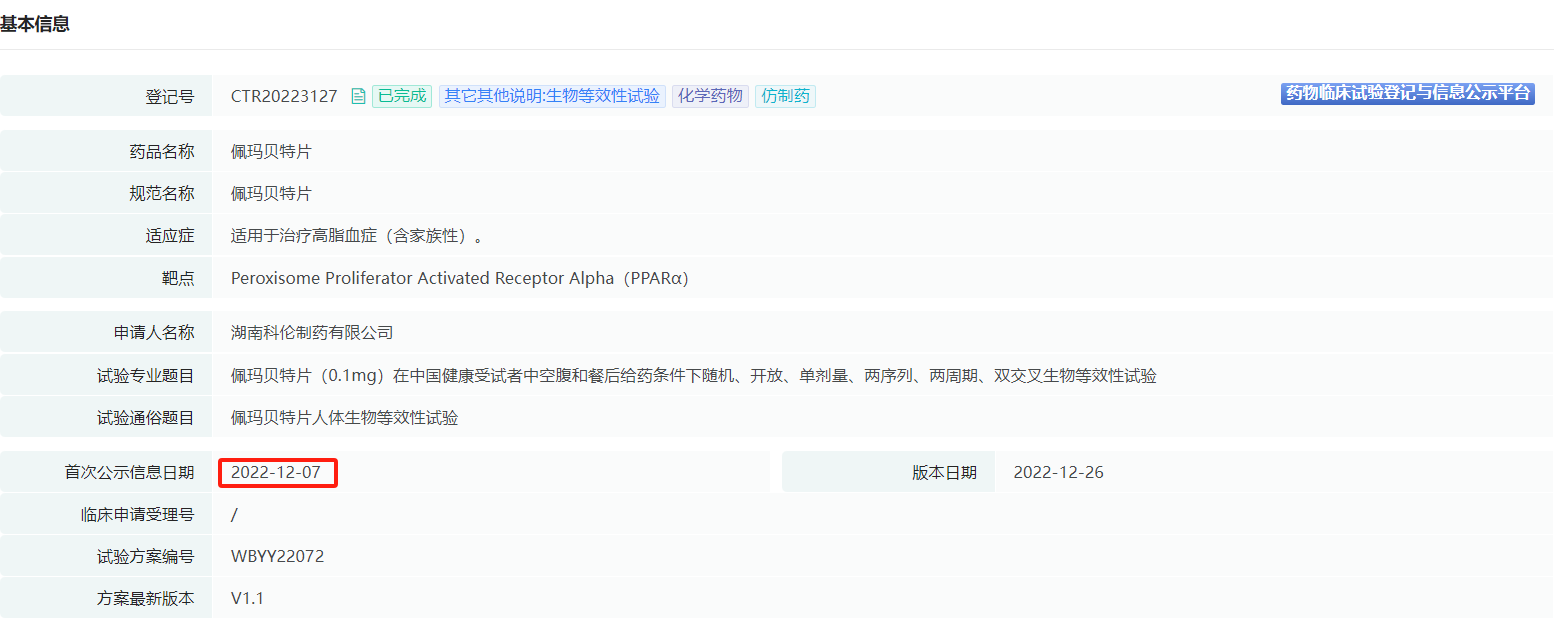
截图来源:摩熵医药数据库
这个时间间隔是不是有点熟悉?同样是原研尚在进行Ⅲ期试验时,同样是多家一起进行BE试验。
更重要的是,佩玛贝特片的核心专利均已过期,这相当于国内只要仿制过评就能上市销售了。
无独有偶,赛诺菲的瑞舒伐他汀依折麦布片24年1月2日在国内上市,24年1月12日石家庄四药4类仿制就被受理,福克制药的熊去氧胆酸口服混悬液24年7月19日在国内上市,24年7月30日,青峰医药的4类仿制就被受理。
从一代代被“围剿”的原研可以看出,这种模式已经屡试不爽了。
首家提交佩玛贝特片仿制上市申请的会是谁?又在那一天呢?让我们拭目以待!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






收藏
登录后参与评论
暂无评论