
8月17日,仁合益康递交的3类仿制化药碳酸氢钠林格注射液上市申请获CDE受理。据药融云数据显示,此前恒瑞医药和科伦制药已获批生产该大涨105%3亿注射液,后又递交了一致性评价补充申请,争国内仿制药首家!
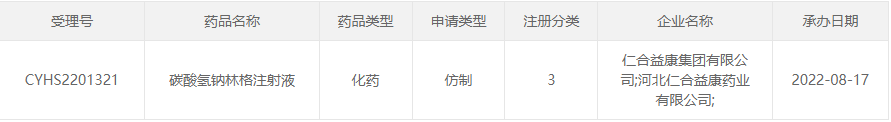
截图来源:CDE官网
碳酸氢钠林格注射液,为复方电解质注射液,用于在循环血液量以及组织间液减少时(如围手术期等情况),作为细胞外液的补充调节剂,纠正代谢性酸中毒。碳酸氢钠林格是第五代升级版的产品,配比与血浆最为接近、代谢不经过肝肾,通过呼吸代谢,不增加肝肾负担,针对肝肾功能不全患者的液体治疗,优势显著。
该药品原研来自日本大冢,2010年在日本获批上市,目前原研尚未进入国内。2019年恒瑞医药获批生产碳酸氢钠林格注射液(规格:500ml),为国内首仿;同年,科伦药业也先后获批500ml和1l两个规格。随后科伦制药和恒瑞医药先后在多省对碳酸氢钠林格注射液主动降价,降幅高达82%。
据药融云统计,2021年碳酸氢钠林格注射液院内销售额近3.5亿元,较2021年实现了销售额翻番,今年也保持了良好的上升趋势。市场竞争方面,2021年恒瑞医药占据了超8成的市场份额,优势较大。
碳酸氢钠林格注射液院内销售情况
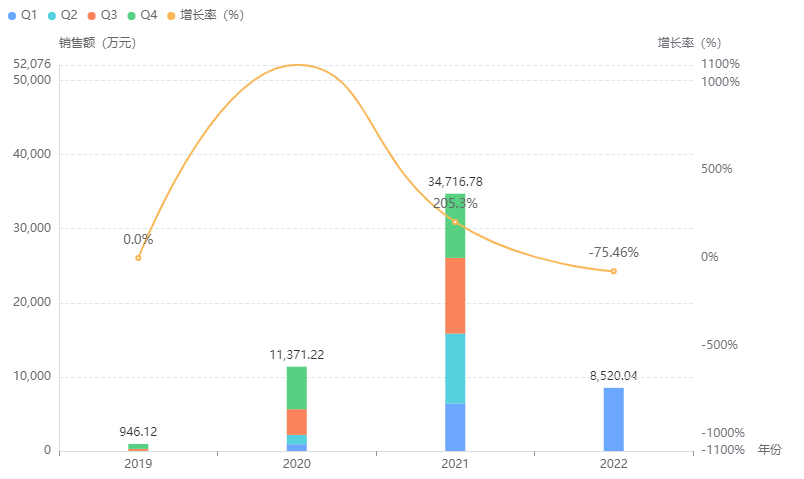
截图来源:药融云全国医院销售数据库
据药融云数据显示,恒瑞医药和科伦制药均递交了碳酸氢钠林格注射液的仿制药一致性评价补充申请。除了本次以新注册分类申报上市的仁合益康外,湖北多瑞药业、中国大冢制药、西安万隆制药和四川美大康佳乐药业也递交了3类仿制上市申请。目前暂无企业过评。
碳酸氢钠林格注射液仿制药申报情况
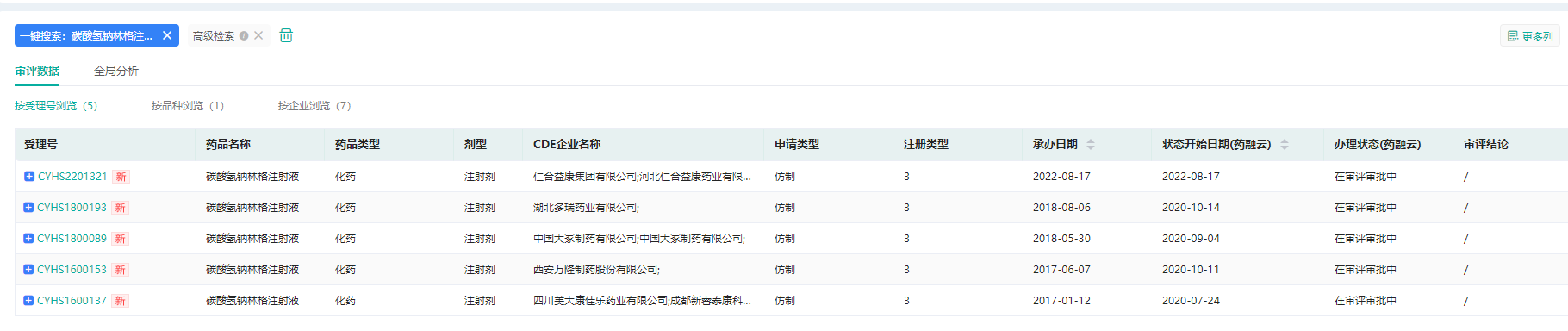
截图来源:药融云中国药品审评数据库
参考来源:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药企仿制药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企仿制药申报情况、审批信息、最新进展、一致性评价、市场竞争格局、销售情况,市场规模与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论