
近日,NMPA发布最新一批药品批准证明文件送达信息,其中,扬子江药业的瑞戈非尼片获批上市,视同通过一致性评价,斩获该7亿抗癌药的国内首仿药。


截图来源:NMPA官网
瑞戈非尼片(Stivarga)是一种新型口服多激酶抑制剂,靶向血管生成、基质和致癌受体酪氨酸激酶(RTK)。瑞戈非尼片原研来自拜耳(Bayer),最早于2012年09月获FDA批准了上市。作为转移性结直肠癌、胃肠道间质瘤及肝细胞癌治疗药物,拜耳的瑞戈非尼片已在美国、欧盟、日本等90多个国家和地区批准使用。据悉,2011年拜耳的瑞戈非尼片全球销售额为5.8亿美元。
在国内,瑞戈非尼片最早于2017年获批上市,2018年10月10日,瑞格非尼正式进入国家医保乙类报销目录,限用于肝细胞癌二线治疗、转移性结直肠癌三线治疗和胃肠道间质瘤三线治疗。在医保降价后价格为196元(40mg/片),降幅45.56%。次年,瑞戈非尼片在院内的销售额一举突破4亿元,随后稳定增长,2021年院内销售额超7亿元,同比增长22%。
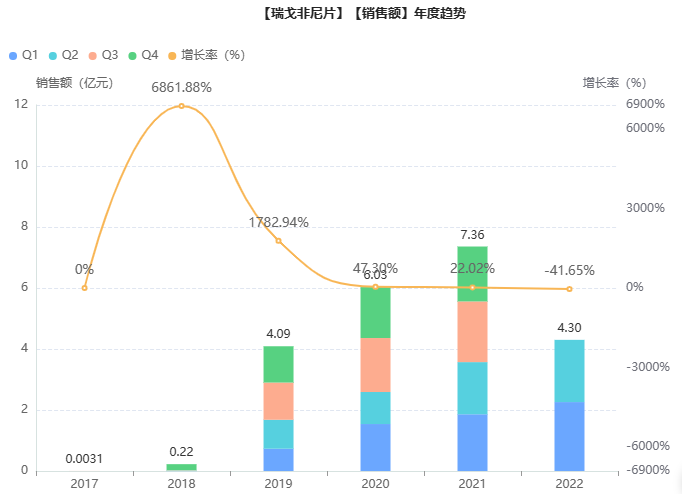
截图来源:药融云全国医院销售数据库
此次扬子江药业的瑞戈非尼片为国内首仿药。此外还有多家药企布局该品种,南京正大天晴、齐鲁制药、科伦药业、北京双鹭、上海创诺、江苏豪森药业、华东医药等公司的上市注册申请均被CDE承办。北京轩升制药、重庆药友制药等药企的BE试验也正在进行中。
据药融云统计,2022年扬子江共有35款药物过评,含7款首家过评,其中舒更葡糖钠注射液、注射用磷酸特地唑胺等2款药物均为国内首仿药。此次在2023年的年初就拿下一款首仿药,实属开了一个好头,期待扬子江在2023年能给市场带来更多好消息。
参考来源:
[1] NMPA官网
[2] 药融云数据库
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论