
药融云数据库显示:2023年6月27日,齐鲁制药的1类新药伊鲁阿克(Iruplinalkib)(曾用名:依鲁奥克,代号为WX-0593)正式在中国获批上市,用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
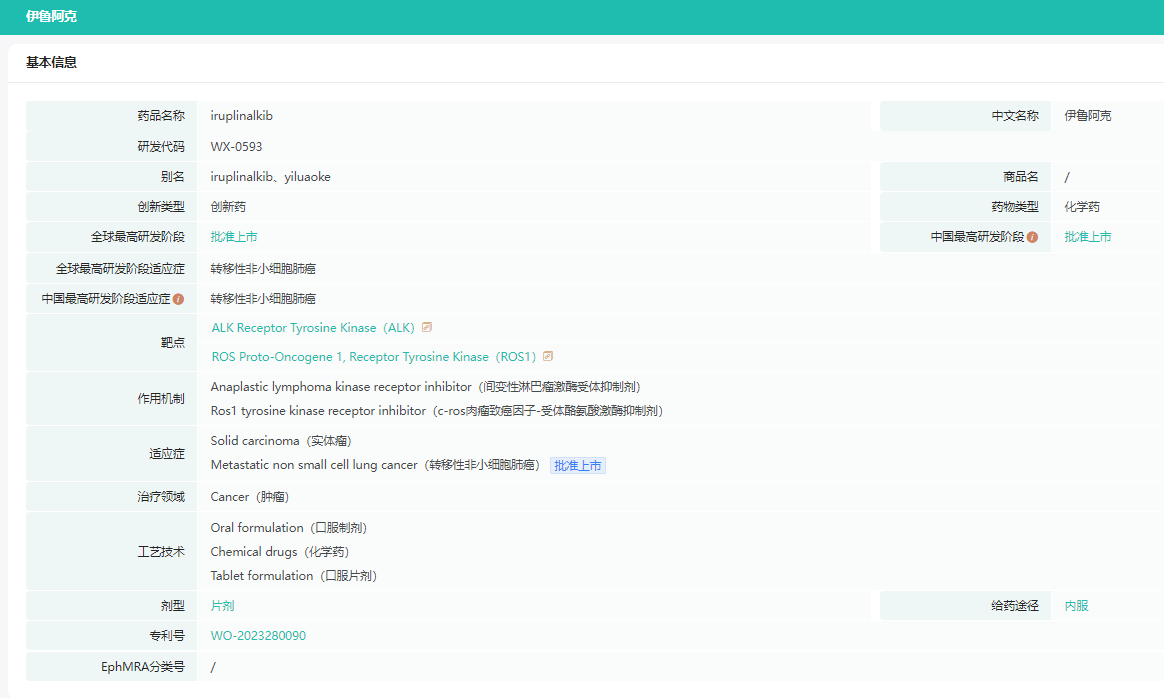
截图来源:药融云全球药物研发数据库
2023年1月,伊鲁阿克临床试验研究(WX0593-003,NCT04641754)结果发表在医学杂志《BMC Medicine》上。
该研究入组克唑替尼耐药的ALK阳性NSCLC受试者146例,本次数据截止日期为2021年11月30日,中位随访时间18.2个月。IRC评估的ORR为69.9%,疾病控制率(DCR)为96.6%,中位无进展生存期(PFS)和缓解持续时间分别为19.8个月和14.4个月,总体生存期(OS)尚未成熟。在基线有脑转移的90例患者中,IRC评估的ORR为63%。而在基线有颅内可测量病灶的42例患者中,颅内ORR(iORR)为64%。治疗相关不良事件(TRAE)的发生率为93.2%,剂量暂停、降低和终止的比例分别为14.4%、11.0%和2.7%。
非小细胞肺癌(NSCLC)是肺癌中最常见的病理组织学类型,约占肺癌的85%,其早期诊断难,患者预后差,往往一经确诊就已经处于晚期,是肺癌患者致死率高的主要原因。间变性淋巴瘤激酶(ALK)作为晚期NSCLC的重要治疗靶点之一,因其靶向药物有良好的治疗效果,因而该靶点被冠以“钻石突变”的称号。随着ALK抑制剂不断取得突破,ALK阳性晚期NSCLC也正在逐步“慢病化”。
2013年6月,齐鲁制药开展创新化合物的设计合成与筛选评价,确定候选化合物,并相继开展工艺开发及早期药学研究、临床前药理毒理评价、样品稳定性研究,并于2016年4月申报临床,同年12月获批临床。本品相关专利WO-2023280090。DDSU对本品开发亦有贡献。
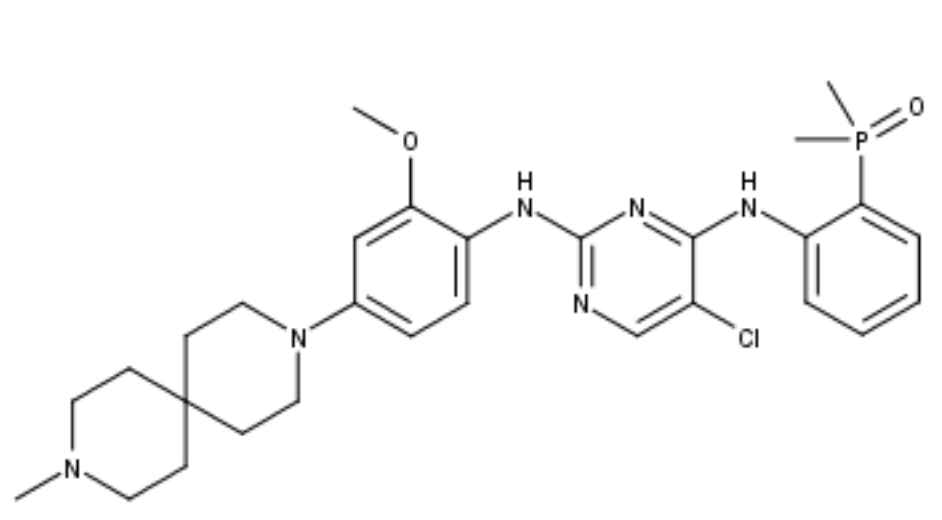
伊鲁阿克(Iruplinalkib)结构式
2017年初,齐鲁制药启动伊鲁阿克(Iruplinalkib)的Ⅰ期临床研究。2019年第二季度根据研究结果快速制订科学合理的临床研究策略,同步开展Ⅱ期和Ⅲ期临床研究。2021年7月以Ⅱ期临床研究结果向国家药品监督管理局递交新药上市申请,2023年4月完成III期临床申报生产并受理。
自6月底正式获批之后,北京、上海、广州等地已于7月12日开出首处方,药融云数据库显示:60mg*90片一盒价格为23800元人民币。

抗体组合新药递交NDA
2023年第59届美国ASCO,免疫治疗领域组合抗体新药QL1706有四项临床研究成果入选2023 ASCO,并以壁报的形式展示。四项研究分别涉及肝细胞癌(HCC)、小细胞肺癌(SCLC)、非小细胞肺癌(NSCLC)三个瘤种的治疗。
1.摘要号4077:QL1706或QL1604联合贝伐珠单抗作为晚期肝细胞癌患者一线治疗的一项开放标签、多中心、适应性、Ⅰb/Ⅱ期研究;
2.摘要号8525:QL1706联合卡铂/依托泊苷(EC)作为广泛期小细胞肺癌(ES-SCLC)一线治疗的安全性和有效性:Ⅱ期单臂研究结果;
3.摘要号TPS8606:QL1706联合含铂化疗辅助治疗完全手术切除后的Ⅱ-ⅢB期非小细胞肺癌(NSCLC)的随机、双盲、多中心III期临床研究(DUBHE-L-304研究);
4.摘要号TPS9139:QL1706联合化疗一线治疗PD-L1表达阴性、局部晚期或转移性非小细胞肺癌(NSCLC)患者有效性和安全性的随机、双盲、多中心、活性对照Ⅲ期临床研究(DUBHE-L-303研究)。

截图来源:药融云全中国药品审评数据库
QL1706(PSB205项目)是齐鲁制药研发的双功能组合抗体,可同时抑制PD-1和CTLA-4通路。利用新型组合抗体技术平台MabPair,在单个细胞中以约2:1的比例同时生产2个工程化单克隆抗体,即PD-1 IgG4抗体艾帕洛利单抗(iparomlimab)和CTLA-4 IgG1抗体托沃瑞利单抗(tuvonralimab)。相关专利WO-2022178319。2023年8月12日,本品递交第一项适应症的新药上市申请NDA/BLA。
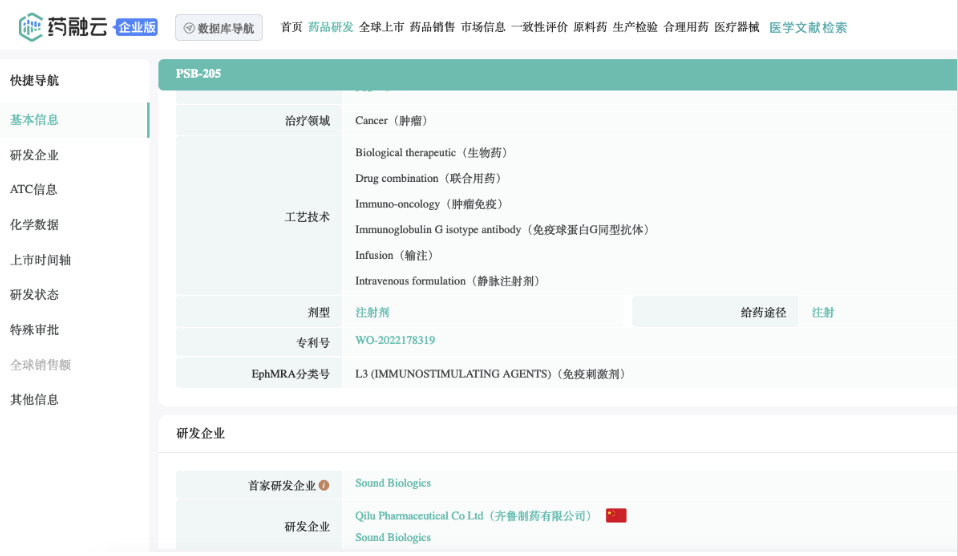
Qilu US Sound Biologics, 美国齐鲁普尚生物制药
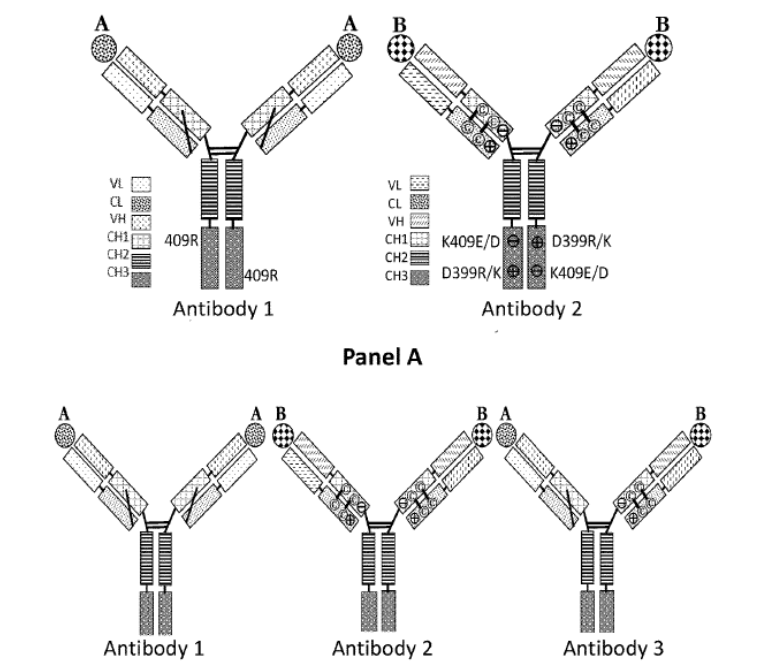
组合抗体技术平台MabPair
关于齐鲁制药
齐鲁制药集团业务涵盖人用药、农药、兽药三大板块。2022年业绩达375亿人民币(其中安可达/贝伐珠单抗业绩约48亿),研发费用38.9亿(近几年研发投入占销售收入从6%升到10%);纳税金额34.2亿。齐鲁制药产品销往全球90余个国家和地区,2022年出口2.88亿片(支/粒),年出口额达到9.2亿美元、同比逆势上扬21%。
齐鲁药物研发体系已经拥有4400余人的创新队伍。目前拥有小分子药化精准设计平台、蛋白降解、单克隆抗体、双特异性抗体、抗体组合(MabPair)、溶瘤病毒、ADC技术平台、纳米药物递送、mRNA、siRNA等核心技术平台。在肿瘤、感染、肝病、自身免疫、代谢疾病等未被满足重大疾病领域已布局完善的创新药物产品线。
据药融云数据库获悉:2023年,齐鲁制药研发投入(R&D)预计将达到51亿元的新高度。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论