医药洞见
-
荣昌生物申报第4款ADC新药,靶点为Claudin 18.2!国内外近二十家企业扎堆
2021年7月19日,荣昌生物第4款ADC(抗体偶联药物)新药RC118的临床试验申请获得NMPA受理 。RC118是荣昌生物众多研发管线中的第四款ADC新药,靶点为Claudin 18.2。 -
7.9-7.18公示104项临床试验,涉及罗氏、恒瑞、阿斯利康等企业的60款国内外新药
7.9-7.18公示104项临床试验,涉及罗氏、恒瑞、阿斯利康等企业的60款国内外新药7月中旬中国临床试验 数据统计时间段为2021年7月9日-2021年7月18日,药融云将定期公示中国临床试验进展情况,关注公众号即可定期查看。如有疏漏,欢迎指正! -
28个创新药申请临床|5款新药报产|6款新药获批!国内首个英夫利西单抗生物类似药获批
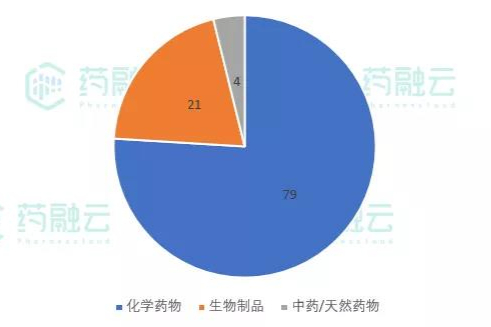
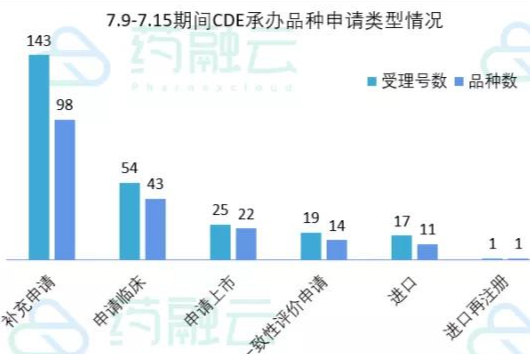
2021.07.09-202107.15期间药审中心受理总量为259个,涉及品种186个,数据统计时间段为2021年7月9日-2021年7月15日,药融云将定期公示一致性评价过评信息 -
2021/7/1-7/8公示79项临床试验|涉及阿斯利康、诺华、默沙东等37款新药
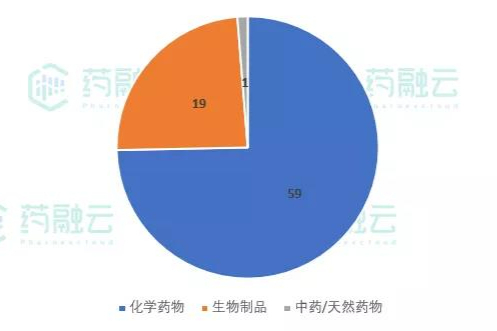
2021年7月1日-7月8日,CDE新公示临床试验共计79项。从药品类型来看,化学药物共计59项,生物制品19项,中药/天然药物1项。 -

AML新药|FLT3抑制剂吉瑞替尼中国售价及审评报告来袭
急性髓系白血病(AML)是一组异质性很强的恶性血液系统肿瘤,AML发生和进展与众多基因突变相关,如FLT3、NPM1、CEBPA、TP53等等。其中,FLT3基因尤为重要,其为AML最常见的基因突变(FLT3基因突变是急性髓系白血病(AML)最常见的基因改变和预后不良因素,存在约25-30%的AML患者中)。FLT3突变型AML患者总体生存较差。 -

29个创新药申请临床,5款新药报产,3款新药获批!汇伦医药、乐普生物、人福医药重磅发力
2021年7月1日至7月8日期间,共有3款国产新药、5款进口药获批上市;另有26个品种通过(含视同通过)一致性评价。有秦皇岛爱晖药业「盐酸美金刚口服溶液」等2款首仿获批上市,中国首款汇伦医药「注射用左亚叶酸钠」重磅获批 -
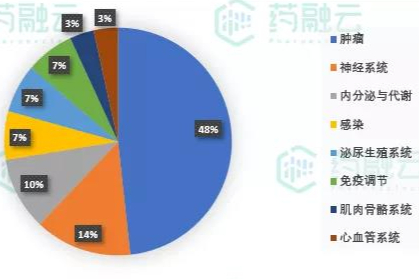
29款创新药和疗法获FDA批准,出海企业健友、复星、东阳光等获40个ANDA批文
29款创新药和疗法,包含21个新分子实体,6个生物制品和2款细胞疗法。其中25款药物为全球首次获批上市。 34款改良型新药 400款仿制药,其中57个仿制药为暂定批准(详见药融云数据库) -
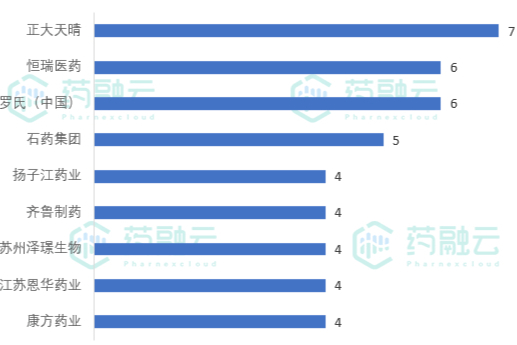
2021年6月CDE中国BE临床试验公示|251项试验_数较上月下降5%
2021年6月1日至6月30日,CDE新公示临床试验共计251项。从药品类型来看,生物制品56项,中药/天然药物11项,化学药物共计184项,占试验总数的73%,其中包括BE试验92项。 -
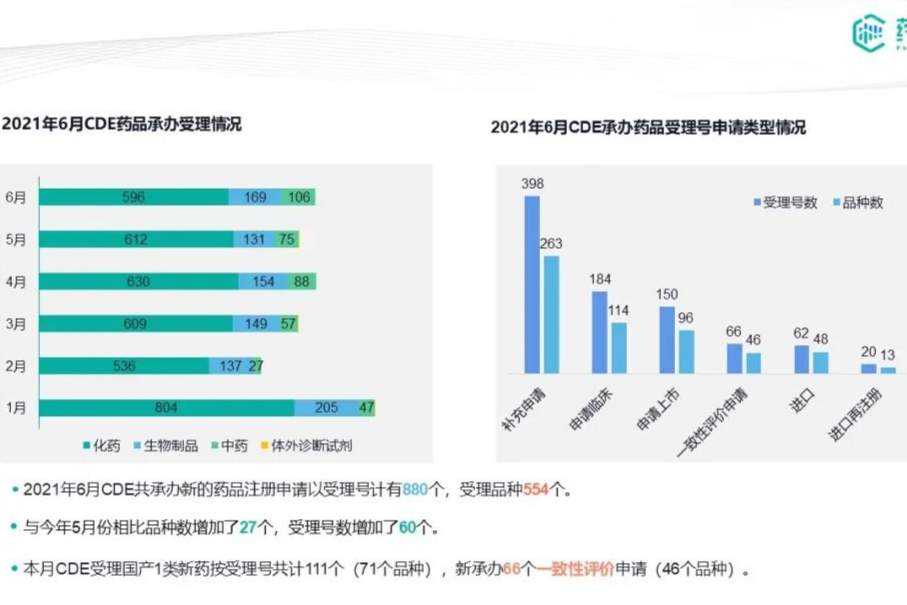
2021年6月|CDE药品审评报告-27个首家过评,扬子江|齐鲁|华润医药大丰收
6月CDE药品审评报告要点 ,27个首家过评,扬子江、齐鲁、华润医药大丰收!6月CDE药品审评报告要点 本月药审中心受理总量为880个 共有111个1类新药申请获CDE受理 本月新承办66个一致性评价申请 13款1类新药获批,泽璟生物1类创新药甲苯磺酸多纳非尼片重磅获批 113个品种通过(含视同通过)一致性评价,扬子江、齐鲁、华润医药大丰收 27个品种首家过评,齐鲁制药斩获2款首家 -
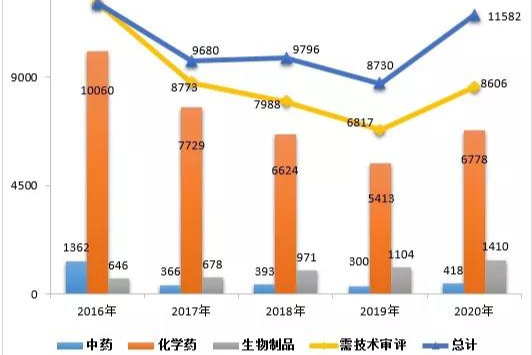
2020年药品审评报告|CDE最新发布
2020年,根据《药品注册管理办法》(国家市场监督管理总局令第27号)、《国家药监局关于实施<药品注册管理办法>有关事宜的公告》(2020年第46号,以下简称46号公告)及《药品注册管理办法》相关配套文件,药审中心完成中药(包括民族药,下同)、化学药、生物制品各类注册申请审评审批共11582件(含器械组合产品4件,以受理号计,下同),较2019年增长32.67%(如无说明,以注册申请件数计,下同)。其中,完成需技术审评的注册申请8606件(含5674件需药审中心技术审评和行政审批注册申请),较2019年增长26.24%;完成直接行政审批(无需技术审评,下同)的注册申请2972件。2020年底正在审评审批和等待审评审批的注册申请已由2015年9月高峰时的近22000件降至4882件(不含完成技术审评因申报资料缺陷等待申请人回复补充资料的注册申请)









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息