
11月23日,成都倍特药业申报的3类仿制药奥贝胆酸片临床试验申请获CDE受理。目前天晴、恒瑞、扬子江、科伦、复旦张江、康弘药业、泽璟生物等企业均布局该品种。
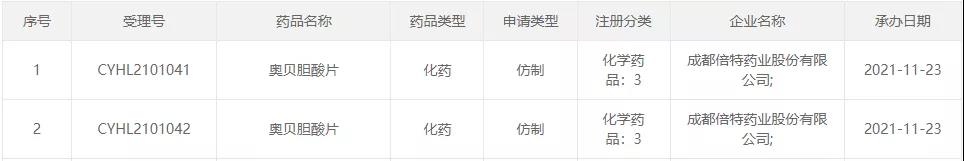
截图来源:CDE官网
据药融云全球药物研发数据库,奥贝胆酸(obeticholic acid,商品名Ocaliva)是Intercept公司开发的一种法尼酯X受体(FXR)激动剂,最早于2016年6月获得FDA批准用于治疗原发性胆源性肝硬化,后陆续在欧盟、加拿大、澳大利亚等国家获批上市。2020年,奥贝胆酸销售额突破3亿美元,同比增加25%。
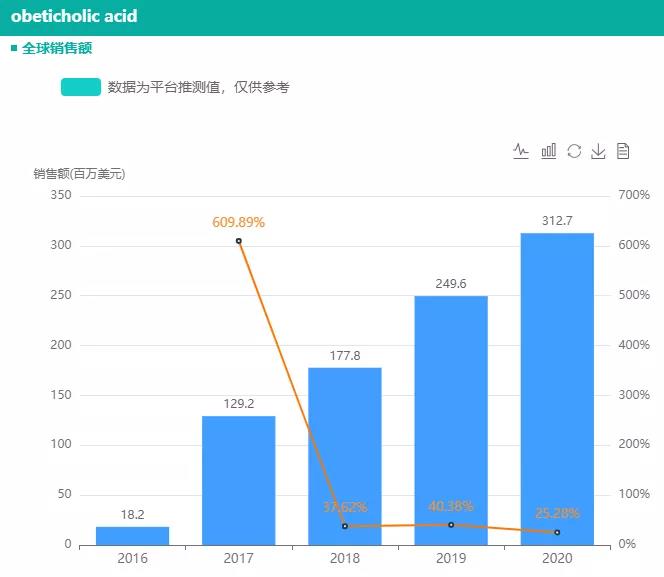
截图来源:药融云全球药物研发数据库
该药其他还在研发的适应症包括非酒精性脂肪性肝炎(NASH)、腹泻、门静脉高压症、胆道闭锁等,其中NASH是奥贝胆酸又一主攻方向,临床试验表现优异,Intercept公司于2019年向FDA和欧盟递交上市申请,有望成为FDA批准的第一款治疗NASH肝纤维化药物。
但次年6月29日,该申请被FDA拒绝(完全回应函CRL),原因在于FDA认为中期组织学终点数据带来的获益仍具有不确定性,并建议 Intercept 提供正在进行的 REGENERATE 后续有效性和安全性数据,以评估是否达到获益风险比。
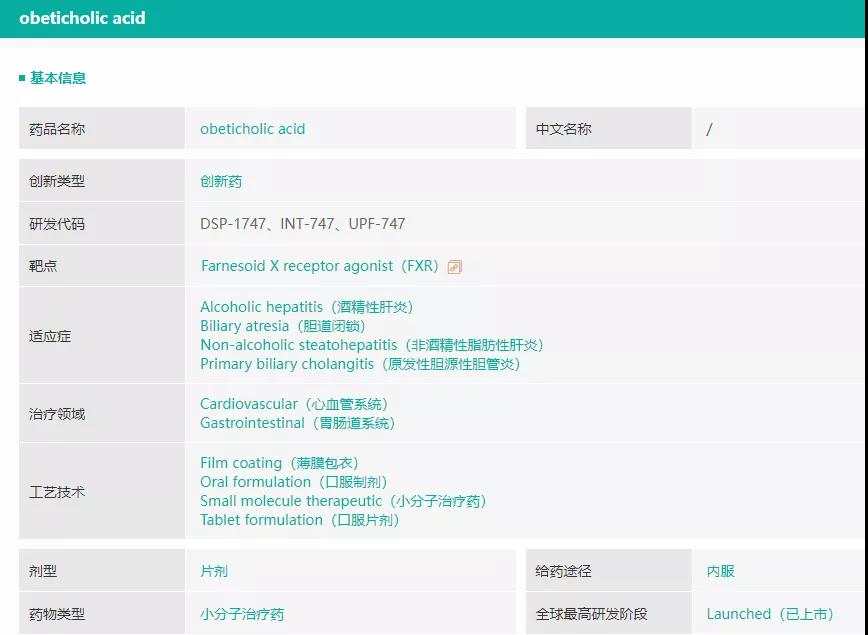
截图来源:药融云全球药物研发数据库
目前,奥贝胆酸原研在中国尚无申报。此前有正大天晴和恒瑞医药进展最快,先后递交了上市申请,均未通过。泰州复旦张江、扬子江药业、四川科伦和此次的成都倍特药业递交了临床试验申请,前2家已获准开展临床。
国内奥贝胆酸的申报情况
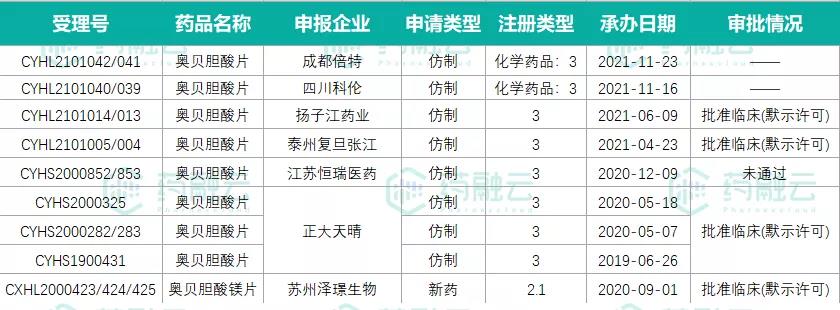
数据来源:药融云药品审评数据库
苏州泽璟生物以2.1类改良型新药报批了奥贝胆酸镁片,已获批临床,适应症为原发性胆汁性胆管炎及非酒精性脂肪肝炎(NASH)。
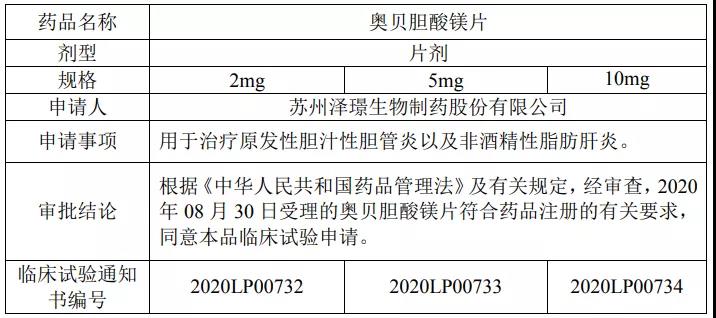
此外,还有华润三九医药、成都康弘药业正在开展BE试验。
潜力FXR赛道,国内歌礼、天晴领先
据了解,FXR是代谢类疾病药物的靶点,主要表达于肝细胞核,通过与配体结合,它不仅能抑制胆汁酸合成和重吸收、调控肝脏和循环系统胆汁酸浓度,还可以抑制脂肪合成促进脂肪酸氧化、调控肝脂和血脂,同时促进肝脏糖原合成、抑制肝糖异生、维持机体血糖平衡。由于胆汁酸在肝脏炎症和纤维化中扮演重要角色,而糖脂代谢紊乱又是脂肪肝的主要诱因,FXR因此成为了研究人员开发改善肝脏脂肪变性、炎症和纤维化药物的理想靶点。
在研众多在研肝病药物靶点当中,FXR激动剂属于“小众”类型。据药融云全球药物研发数据库,全球范围内的FXR靶向药物,目前仅有奥贝胆酸一款获批上市。
在研药物中,吉利德的cilofexor tromethamine进展最快,已到临床三期阶段;歌礼制药的ASC-42、正大天晴的TQA-3526、Metacrine的MET-409、诺华的tropifexor和nidufexor、Enanta 的EDP-305、法国ENYO的vonafexor和礼来的TERN-101已进入临床二期阶段。国内还有雅创医药、陕西麦科奥特科技、中科院、广州海普丁生物等企业机构进行FXR靶向药物的研发。
—END—





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论