近期,全球实体瘤CAR-T细胞疗法领军者科济药业2022年财报发布:2022年公司净亏损达到人民币8.92亿元,相较于2021年47.44亿元,同比收窄81.2%,净亏损减少的主要原因为发行予投资者的金融工具的公平值亏损减少。2022年研发费用6.8亿元,同比增长35%,主要由于支持临床试验而产生的测试及生产开支增加以及北卡罗来纳州的工厂设施投入使用产生的额外费用。

目前,科济药业总市值为80.08亿元,随着NMPA已受理CT053的上市申请,在美国及加拿大进行的2期临床试验的入组正在进行中,科济药业的首个商业化产品即将落地,验证公司在CAR-T细胞疗法领域的竞争力。
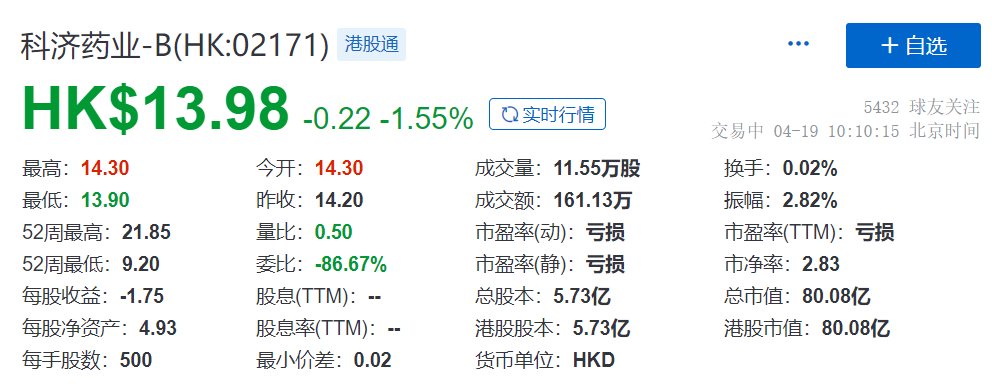
一、泽沃基奥仑赛注射液
据药融云数据库显示,2022年10月,科济药业的泽沃基奥仑赛注射液(CT053)的新药上市申请获得国家药品监督管理局受理,并纳入优先审评(本品适用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的复发或难治性多发性骨髓瘤成年患者),目前国内尚无同类产品获批。
截图来源:药融云中国药品审评数据库
泽沃基奥仑赛是一款全人抗自体BCMA CAR-T细胞疗法产品,用于治疗复发/难治多发性骨髓瘤。此NDA被受理是基于在中国进行的开放、单臂I/II期临床试验(LUMMICAR STUDY 1(方案编号:CT053-MM-01))的数据。研究结果显示,泽沃基奥仑赛注射液具有良好的安全性和疗效。泽沃基奥仑赛注射液对伴随细胞遗传学高危的患者同样呈现出良好的治疗效果。
泽沃基奥仑赛药物研发信息(部分,欢迎登陆“药融云数据库www.pharnexcloud.com/?mh”查看更多)
截图来源:药融云全球药物研发数据库
01.新药上市申请于2022年10月获国家药品监督管理局受理,并纳入优先审评
02.美国2期研究数据亮相第七届CAR-TCR年度峰会
03.中国关键性II期研究最新进展亮相ASH 2022
04.中国研究者发起的试验的最新进展发表于《Haematologica》期刊
05.获“2017中国企业最佳实践”称号
二、CT041
CT041是世界上第一款也是唯一一款进入II期临床试验的治疗实体瘤的CAR-T细胞疗法,目前正在国内开展GC/GEJ确证性II期临床。正在中国、美国和加拿大开展多项针对胃癌、胰腺癌的临床试验。根据公司年报披露,公司计划在2024H1向NMPA提交NDA,CT041在美国的2期临床试验计划于2023年上半年启动。
CT041适应症研发现状
截图来源:药融云全球药物研发数据库
三、相关外部合作
2023年1月,科济药业和华东医药股份有限公司(股票代码:SZ.000963)(「华东医药」)全资子公司华东医药(杭州)有限公司关宏宇在中国大陆地区商业化科济药业的主要候选药物泽沃基奥仑赛注射液签订合作协议。
2023年1月,科济与F. Hoffmann-La Roche Ltd(「罗氏」)签订合作协议,就科济的研究药物AB011与罗氏的PD-L1检查点抑制剂阿替利珠单抗及标准治疗化疗,开展联合用药治疗GC/GEJ患者的临床试验进行评估。
四、关于科济药业
科济药业是一家在中国及美国开展业务的创新型生物制药公司,主要专注于治疗血液瘤和实体瘤的创新CAR-T细胞疗法。
截图来源:药融云投融资数据库
自2014年开始运营以来,科济药业已内部开发多项新技术以及拥有全球权益的产品管线,以解决CAR-T细胞疗法面临的重大挑战,比如提高安全性、提高实体瘤的疗效,和降低治疗成本。科济药业的产品管线包括升级版的全人源靶向BCMA CAR-T,全球唯一获得IND临床试验许可的全球潜在同类首创Claudin18.2 CAR-T,以及全球潜在同类首创的GPC3 CAR-T。对于CAR-T细胞疗法,科济药业已经在中国、美国、加拿大获得一共8个IND批件,是目前中国CAR-T公司中最多的。
在由经验丰富的学术专家和行业资深人士组成的管理团队的领导下,科济药业建立了一个整合的细胞治疗平台,内部能力涵盖靶点发现、先导抗体开发、临床研究和商业化规模生产。
科济药业的研发管线
参考资料:
[1] 药融云数据库
[2] 科济药业公司官网
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论