据CDE官网最新公示,上海迪赛诺/江苏诚康药业递交的马来酸阿伐曲泊帕片上市申请获受理。据药融云查询,目前该4亿慢性肝病药在国内仅原研获批,是复星医药的独家品种。现至少已有8家药企申报上市,争抢国内首仿药。
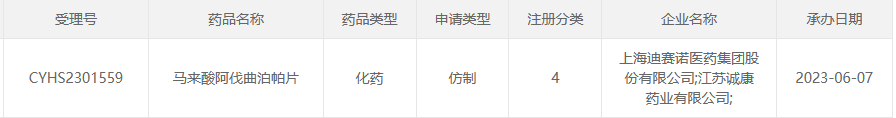
截图来源:CDE官网
阿伐曲泊帕原研来自美国AkaRx公司,是一款血小板生成素受体(TPO-R)激动剂,于2018年5月获FDA批准上市(商品名:Doptelet®),用于CLD相关血小板减少症的成年患者,这是全球首个FDA批准用于慢性肝病(CLD)相关血小板减少症的口服血小板生成素受体激动剂(TPO-RA)。
2018年3月,复星医药子公司上海复星医药获得美国AkaRx,Inc.关于该新药在中国大陆及香港特别行政区的独家开发及商业权利。2020年4月,阿伐曲泊帕正式获得国家药品监督管理局批准进入国内,商品名苏可欣,用于择期行诊断性操作或者手术的慢性肝病相关血小板减少症的成年患者治疗。这是复星医药首个引进的小分子创新药,也是国内首个获批用于慢性肝病相关血小板减少症的药物,现已纳入医保目录(乙类)。
据药融云数据库显示,苏可欣自上市后便开始了高速放量,次年院内销售额便突破1亿元,2022年达3.9亿元,同比增长187%。目前,阿伐曲泊帕仅原研一家拥有批文。
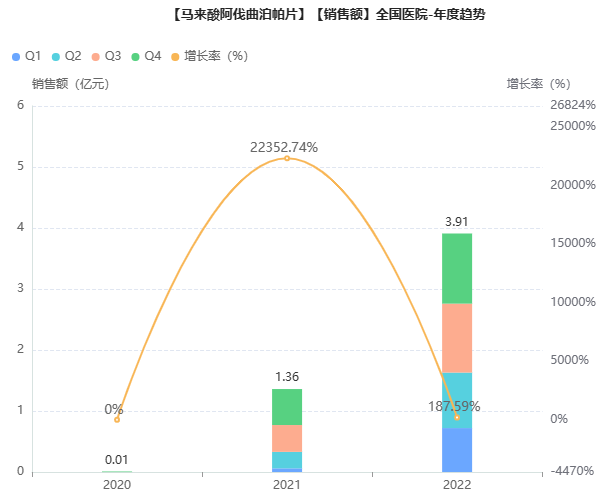
截图来源:药融云全国医院销售数据库
2022年12月,复星医药递交了马来酸阿伐曲泊帕片的新适应症(用于治疗对既往治疗反应不佳的成人慢性免疫性血小板减少症(ITP))上市申请(受理号:JXHS2200120),正在审评审批中。
与此同时,多家药企也正在布局阿伐曲泊帕,国内首仿药席位空缺。目前已有南京正大天晴(首家申报)、北京康蒂尼药业/南京海纳制药、成都倍特、北京凯因格领生物、桂林南药、齐鲁制药、南京恒生制药和此次的上海迪赛诺医药等8家药企递交了马来酸阿伐曲泊帕片的上市申请,均在审评审批中。另有四川科伦药业、江苏万邦生化、奥赛康药业等药企正在开展BE试验。该品种今后竞争愈发激烈。
参考来源:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论