
全球首次获批
2023年11月17日,美国FDA批准由阿斯利康(AstraZeneca)开发的“first-in-class”新药AKT抑制剂Truqap(Capivasertib)上市,与Fulvestrant(氟维司群)联合使用,治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的晚期或转移性乳腺癌成年患者(至少携带一种PIK3CA、AKT1或PTEN基因突变)。
此前在2023年6月12日,FDA已授予Capivasertib+氟维司群的新药申请(NDA)优先审评资格,不到半年的时间快速获批。
Capivasertib的关键CAPItello-291临床试验研究结果此前发表于《新英格兰医学杂志》(NEJM)。它是一项随机、双盲、安慰剂对照III期临床试验(NCT04305496),旨在评估Capivasertib+氟维司群用于HR+/HER2-晚期乳腺癌的疗效与安全性。该研究共招募708例绝经前/绝经后女性及男性HR+/HER2-晚期乳腺癌患者1:1随机分为Capivasertib+氟维司群组和安慰剂+氟维司群组,其中共289例(40.8%)患者为AKT通路异常,并且489例(69.1%)患者既往在晚期阶段接受过CDK4/6抑制剂治疗。本研究以总人群和伴有AKT通路异常(至少携带一种PIK3CA、AKT1或PTEN基因突变)患者的PFS(研究者评估)作为双重主要研究终点。
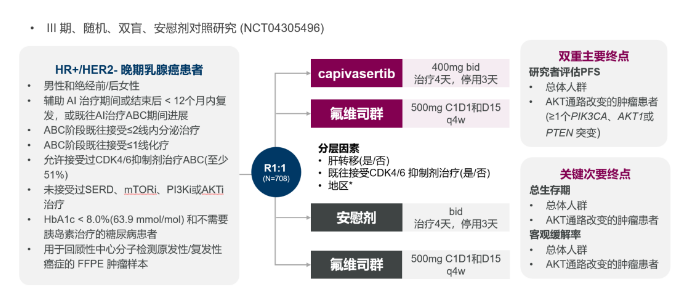
CAPItello-291临床研究设计
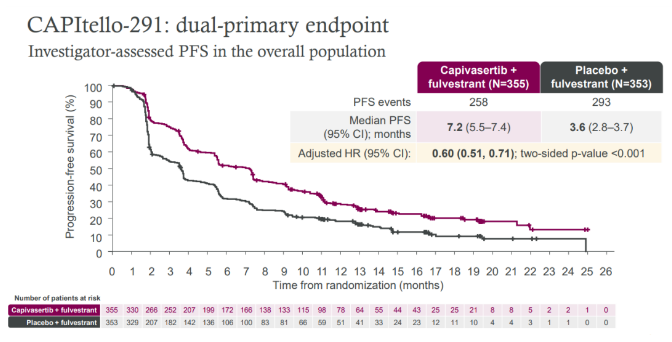
Capivasertib+氟维司群组相比安慰剂+氟维司群组在伴有或者不伴有AKT通路异常的患者人群的中位PFS获益均表现出优势,在总人群中:7.2个月vs3.6个月,HR=0.60;95% CI 0.51–0.71;p<0.001。
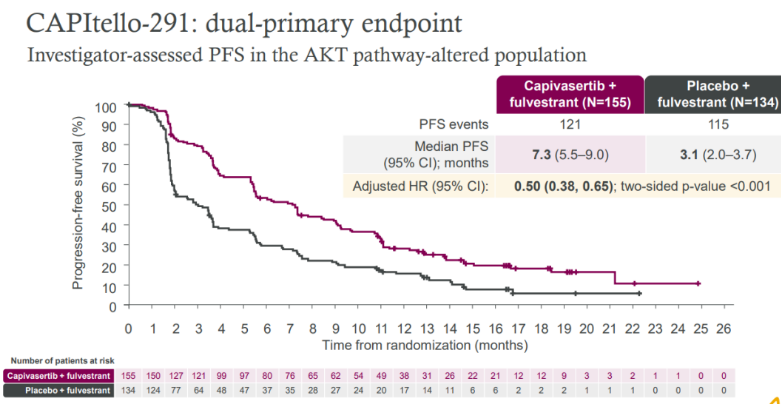
在AKT通路异常人群中:7.3个月vs3.1个月,HR=0.50;95% CI 0.38–0.65;p<0.001;在不伴有AKT通路异常人群中:7.2个月vs3.7个月,HR=0.70;95% CI 0.56–0.88;p<0.001。
安全性数据:主要不良反应为1、2级,最常见的≥3级AE是皮疹(12.1% vs 0.3%)、腹泻(9.3% vs 0.3%)和高血糖(2.3% vs 0.3%)。
接力赛合作开发新药
据药融云数据库显示:Capivasertib是一款三种AKT亚型(AKT1/2/3)的高效选择性抑制剂。AKT,也称为磷酸激酶B (PKB),在涉及细胞生长和分裂、细胞凋亡抑制和血管生成的多种级联信号传导机制中发挥着关键作用。AKT信号通路的激活,包括PIK3CA、AKT1和PTEN的改变,可出现在许多HR+/HER2-的晚期乳腺癌患者中,但也可能出现在没有这些基因改变的患者中。
本品最早由Astex Therapeutics Ltd(大冢制药子公司)与Institute of Cancer Research UK(英国癌症研究所)开发;2005年阿斯利康购买了该产品权益,当时阶段为临床前。相关专利:WO-2009047563。(Under the Agreement, AstraZeneca will provide Astex with an upfront payment of £2.75 million ($5 million), research funding, as well as milestone payments of up to £150 million ($270 million), subject to the satisfactory achievement of development, regulatory and sales targets.)

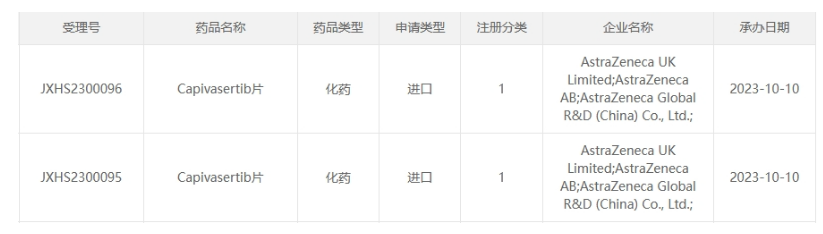
2023年10月,阿斯利康递交的1类新药AKT抑制剂Capivasertib片的上市申请/NDA获NMPA/CDE受理。目前有多项临床试验在中国同时展开。
据药融云数据库显示:本靶点领域在研的还有,罗氏的ipatasertib(GDC-0068)、来凯医药/诺华afuresertib(LAE002)、日本Taiho、默克雪兰诺、正大天晴的NTQ1062、海昶生物的WGI-0301、珍宝岛药业的HZB0071、浙江大学的Hu7691等等。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论