
2月25日,强生宣布其特诺雅达®(古塞奇尤单抗注射液(静脉输注))和特诺雅®(古塞奇尤单抗注射液)的新增适应症获中国国家药监局(NMPA)批准,正式上市用于治疗中重度活动性克罗恩病的成人患者。此前,该药物已在中国获批用于治疗银屑病。

古塞奇尤单抗是强生公司研发的首款获批全人源、双重作用机制的白介素23(IL-23)抑制剂,它通过直接结合IL-23并精准定位至主要分泌IL-23的CD64+炎症细胞,从源头上有效中和该细胞因子,阻断炎症信号传导路径。
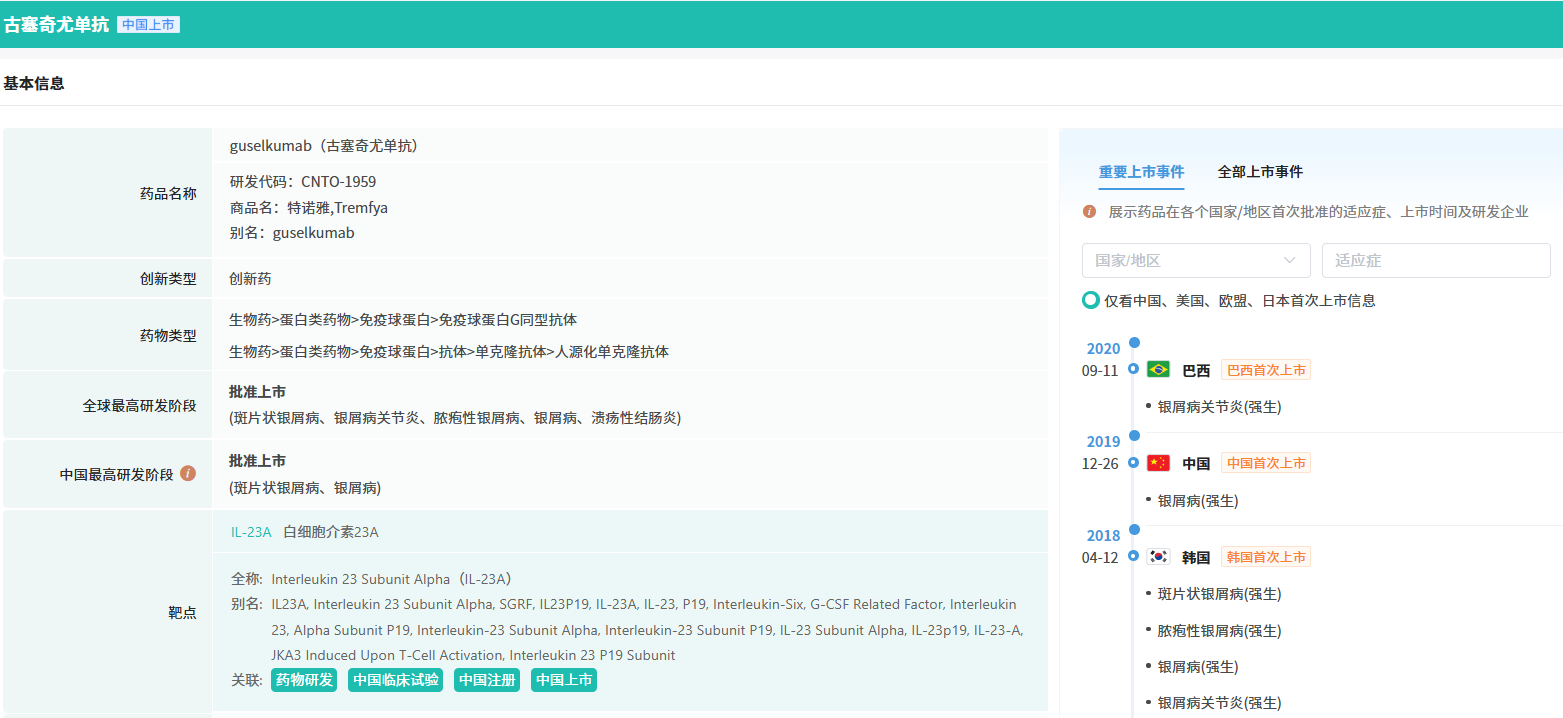
截图来源:摩熵医药全球药物研发数据库
克罗恩病作为炎症性肠病(IBD)的两大主要类型之一,对全球数百万人的健康构成严重威胁。近年来,中国克罗恩病的发病率持续攀升,年发病率在每10万人中约为0.51至1.09例,且发病高峰集中于20至30岁的年轻群体。
作为首个且唯一的全人源、双重作用机制、选择性中和IL-23的抑制剂,古塞奇尤单抗在克罗恩病的治疗领域展现了卓越疗效,显著提高了患者的临床缓解率和深度缓解率,树立了治疗的新标杆。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论