
10月24日,GSK宣布,美国FDA批准其抗体偶联药物(ADC)Blenrep(belantamab mafodotin)联合硼替佐米和地塞米松(BVd),用于治疗至少接受过两种既往疗法的复发或难治性多发性骨髓瘤(RRMM)成年患者。与此同时,GSK正持续推进Blenrep的临床开发,力图将其应用前移至更早治疗线,包括用于新确诊患者。

Blenrep的批准基于关键性3期临床试验DREAMM-7的数据。Blenrep的批准基于关键性3期临床试验DREAMM-7的数据。研究显示,Blenrep联合方案较活性对照组使患者死亡风险降低51%,中位无进展生存期延长至31.3个月,而活性对照组为10.4个月,风险比为0.31。在中位总生存期方面,Blenrep联合治疗组与活性对照组分别为未达到和35.7个月,风险比为0.49。Blenrep联合方案的安全性和耐受性与各单药已知特征总体一致。
Blenrep是一款靶向B细胞成熟抗原的ADC,可通过多重作用机制消除骨髓瘤细胞。由人源化抗BCMA单克隆抗体和细胞毒性药物澳瑞他汀F(auristatin F)通过不可切割的连接子偶联而成,可以通过多重作用机制消除骨髓瘤细胞。
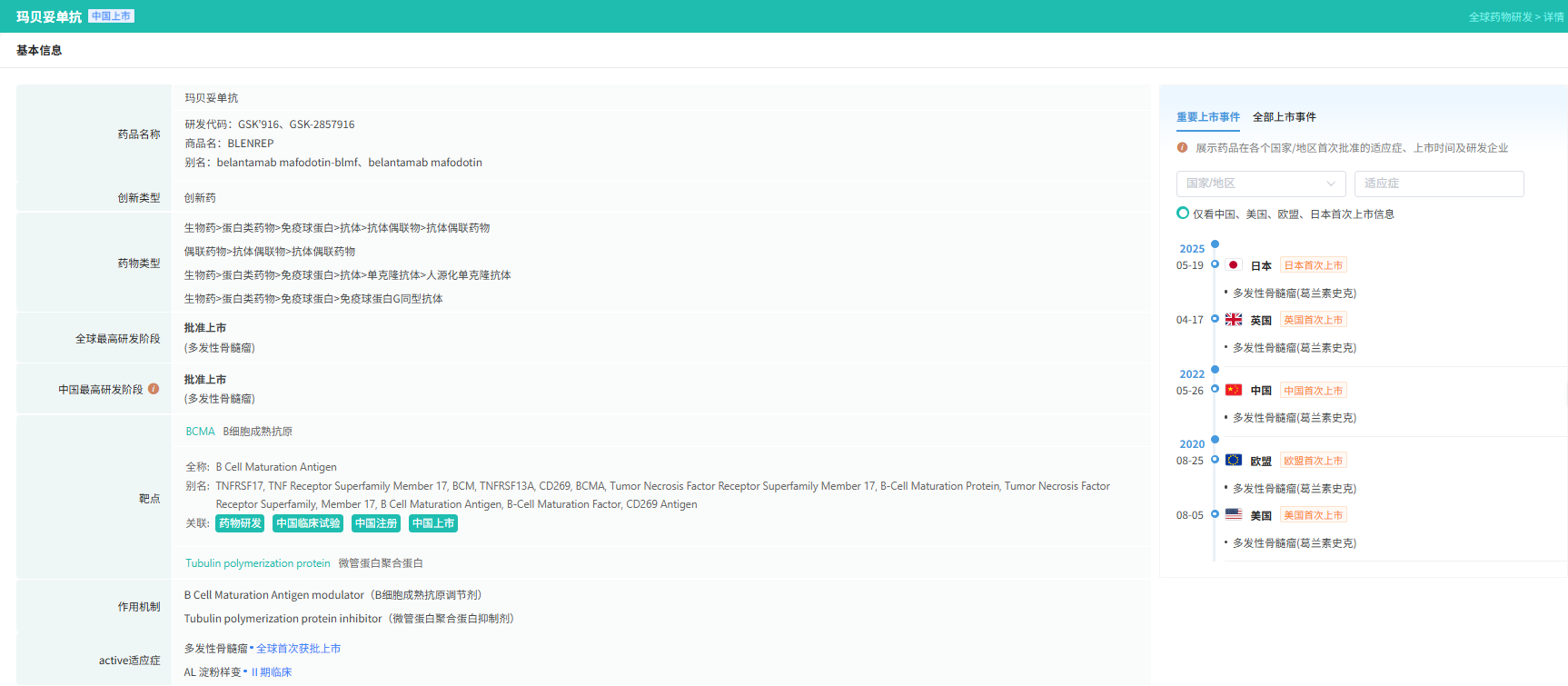
截图来源:摩熵医药数据库-全球药物研发数据库
此次获批也意味着Blenrep成为全球首个获批上市的 BCMA ADC。
GSK正在推进DREAMM临床项目,以证明Blenrep在早期治疗中的潜在益处。对DREAMM-7和DREAMM-8的总生存期(OS)继续进行随访,预计将于2028年初公布数据,包括仅接受过一种先前治疗的患者。
DREAMM -10是一项III期临床试验,用于新诊断不符合移植条件的患者,占开始接受治疗患者的70%以上,于2024第4季度启动。作为一线治疗的Blenrep的中期疗效和安全性数据预计将于2028年初公布,并将扩大美国报名范围,以增加美国患者在研究人群中的代表性。

Blenrep的上市之路并不顺利。早在 2020 年 8 月,基于关键性 Ⅱ 期临床DREAMM-2 研究的结果,该药曾先后获得 FDA 加速批准上市以及 EMA 的附条件批准上市,作为单药疗法治疗复发/难治性多发性骨髓瘤成人患者。
不过,FDA 的加速批准和 EMA 的附条件批准都是有条件的,Blenrep的结果需要在后续 Ⅲ 期临床试验 DREAMM-3 中得到进一步证实才可以。然而,2022 年 11 月,GSK 宣布 DREAMM-3 研究未达到其无进展生存期 (PFS) 的主要终点。基于此,GSK 主动撤回了 Blenrep在美国的上市申请。随后,欧盟 EMA 也撤回了Blenrep的上市许可。
虽然首次上市失利,但Blenrep在后续研究 DREAMM-7 中,显示出积极的效果,终于在又获得 FDA 批准上市。
参考来源:
[1] 企业官网/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
3. 重磅!又一国产BCMA靶向CAR-T细胞疗法来袭,入局千亿市场!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论