1.4.1 本期全球TOP10创新药研发进展
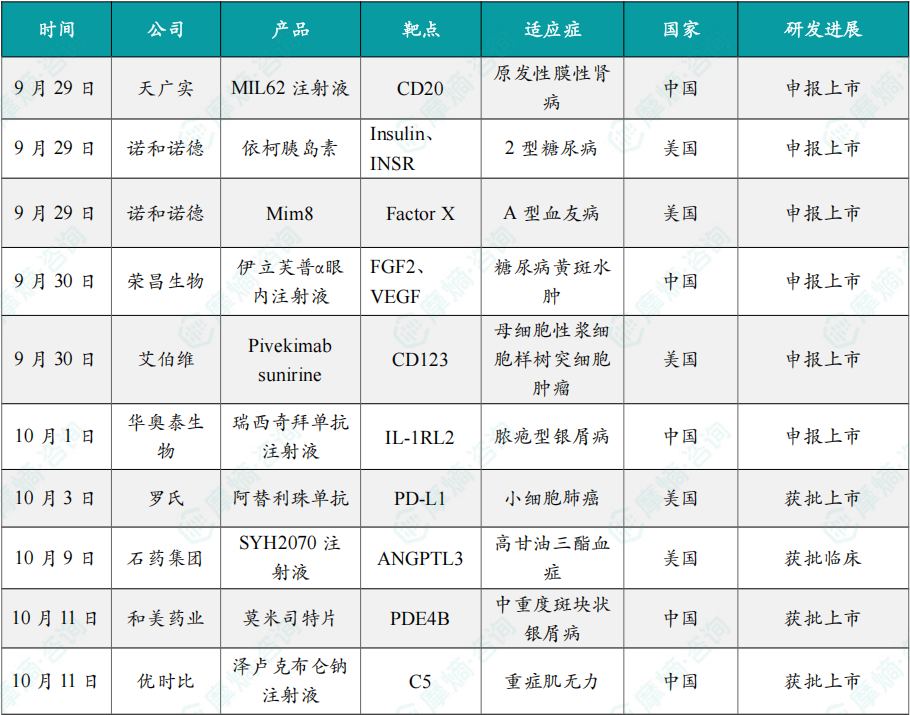
(1)天广实CD20单抗MIL62注射液第2项上市申请获受理
9月29日,天广实发布公告:其创新型第三代CD20单抗MIL62注射液的一项新适应症的上市许可申请已获CDE受理,用于治疗原发性膜性肾病(PMN)。先前,MIL62治疗PMN适应症已被CDE纳入“突破性治疗”药物品种。若能成功获批,MIL62有望成为中国首个获批PMN治疗的特效药物。MIL62为天广实基于自有的ADCC增强抗体平台研发的创新型第三代CD20重组人源化单克隆抗体。此前,MIL62治疗视神经脊髓炎谱系疾病(NMOSD)的新药上市NDA申请已于今年5月获得CDE受理并纳入“优先审评”名单。
(2)诺和诺德的依柯胰岛素在美国申报上市
9月29日,诺和诺德宣布已向FDA递交依柯胰岛素(icodec)的上市申请,用于治疗2型糖尿病。
依柯胰岛素是诺和诺德在口服胰岛素OI338的基础上设计的一款超长效胰岛素制剂,人体内半衰期长达196h。
其核心设计在于:
①将18C长链脂肪酸替换为20C长链脂肪酸,提高分子与人血清白蛋白的结合亲和力;
②将B链16位Tyr(酪氨酸)替换为His(组氨酸),降低分子对人胰岛素受体的亲和力。
目前,该药物已在欧盟和中国获批用于治疗2型糖尿病。
(3)诺和诺德的Mim8在美国申报上市,用于治疗A型血友病
9月29日,诺和诺德宣布已向FDA递交Mim8的上市申请,用于治疗A型血友病。
血友病是一种罕见的遗传性出血性疾病,会损害人体形成血栓的能力,而血栓形成是止血所需的过程。据估计,全球约有112.5万例血友病患者,其中血友病A患者约占所有整体病例的80%-85%。。
Mim8是诺和诺德利用Genmab的DuoBody技术平台开发的一款模拟凝血因子VIIIa(FVIIIa)作用的双抗药物,可桥接凝血因子IXa(FIXa)和凝血因子X(FX),从而起到替代FVIII的作用。其凝血活性约为艾美赛珠单抗的15倍。
(4)荣昌生物眼科创新药伊立芙普α眼内注射液申报上市
9月30日,CDE网站显示,荣昌生物的眼科创新药伊立芙普α(RC28)申报上市,用于治疗糖尿病黄斑水肿(DME)。
伊立芙普α是荣昌生物开发的一款全球首创VEGF/FGF双靶标融合蛋白药物,可同时阻断VEGF和FGF家族的血管生成因子,从而更有效地抑制血管异常生长。其独特的结构设计可以有效避免了单靶VEGF抑制剂的缺陷。
此外,伊立芙普α由VEGFR1、VEGFR2和FGFR1的胞外结构域与人IgG1融合而成,其中IgG1片段可以帮助延长药物在血清中的半衰期,因此可以减少给药频率。对于直接注入患者眼内的药物,减少给药频率可以有效减轻患者不适。
2025年8月,荣昌生物与参天制药全资子公司参天中国达成协议,将伊立芙普α在大中华区及韩国、泰国、越南、新加坡、菲律宾、印度尼西亚及马来西亚的独家开发、生产和商业化权利授予后者,总交易金额为12.95亿元。
(5)艾伯维CD123 ADC在美国申报上市
9月30日,艾伯维宣布已向美国FDA提交了Pivekimab sunirine(PVEK)的生物制品许可申请(BLA)。
PVEK是一种正在研究中的抗体药物偶联物,旨在治疗母细胞性浆细胞样树突细胞肿瘤(BPDCN)这种罕见且治疗选择有限的癌症。PVEK是一种靶向CD123的抗体药物偶联物,目前正处于针对血液恶性肿瘤,包括BPDCN和急性髓系白血病(AML)的临床开发阶段。CD123(IL-3Rα)是一种在BPDCN中过度表达的蛋白质,因此使其成为理想的治疗靶点。
目前,PVEK正在评估其单药治疗BPDCN患者,以及与Vidaza®(阿扎胞苷)和Venclexta®(维奈托克)联合治疗未经治疗和复发/难治性AML患者。2020年10月,FDA授予PVEK治疗复发/难治性BPDCN的突破性疗法认定。
(6)华奥泰生物的瑞西奇拜单抗注射液申报上市
10月1日,CDE网站显示,华奥泰生物的瑞西奇拜单抗(HB0034)申报上市,用于治疗成人泛发性脓疱型银屑病(GPP)发作。
瑞西奇拜单抗(HB0034)是华奥泰子公司华博生物开发的一款抗IL-36R单抗,可通过抑制IL-36通路发挥抗炎的生物学效应。
截至今年3月,HB0034注射液项目已合计花费研发费用约人民币21038万元。今年3月,瑞西奇拜单抗治疗GPP急性发作的关键性II期研究达到了主要终点。结果显示,相比于安慰剂组,瑞西奇拜单抗组单次静脉给药后的第1周GPP发作患者的皮肤脓疱得到明显清除。此外,瑞西奇拜单抗在安全性方面表现良好,未发现新的安全性信号。
(7)罗氏的阿替利珠单抗联合疗法获批ES-SCLC一线维持治疗
10月3日,罗氏宣布,FDA已批准阿替利珠单抗或其皮下制剂联合芦比替定用于广泛期小细胞肺癌(ES-SCLC)成人患者的维持治疗,这些患者在接受由阿替利珠单抗或其皮下制剂、卡铂和依托泊苷(CE)组成的一线诱导治疗后病情未发生进展。
此次批准标志着针对ES-SCLC一线维持治疗的首个且唯一的组合疗法。FDA的批准基于III期IMforte研究的结果,该研究显示,与阿替利珠单抗单药维持治疗相比,阿替利珠单抗联合芦比替定将疾病进展或死亡的风险降低了46%,将死亡风险降低了27%。此次批准建立在阿替利珠单抗在 ES-SCLC 中已确立的作用之上。
2019年,基于 IMpower133 研究,FDA 批准阿替利珠单抗联合化疗用于 ES-SCLC 成人患者的一线治疗,该研究在当时是二十年来针对该患者群体的首个新治疗选择。
(8)石药集团siRNA降脂新药SYH2070注射液在美国获批临床
10月9日,石药集团宣布,该公司自主研发的双链小干扰RNA(siRNA)药物SYH2070注射液已获得美国FDA批准,可在美国开展临床试验。该产品亦于今年9月在中国获批临床。
根据石药集团新闻稿介绍,SYH2070注射液是一款通过偶联乙酰半乳糖胺(GalNAc)实现肝脏靶向递送的siRNA药物,以皮下给药的方式靶向血管生成素样蛋白3(ANGPTL3),能有效降低ANGPTL3水平。通过优化序列和化学修饰的策略,该产品实现更持久的基因沉默效果,有望成为超长效降低ANGPTL3的siRNA药物,适用于治疗高甘油三酯血症或混合型高脂血症,具备有效降低残余胆固醇水平升高风险的潜力。
临床前研究显示,该产品在药物活性和药效持续性方面均优于同类型siRNA产品,展现出药物作用效果持久、安全性良好、患者依从性高等差异化优势,具有较高的临床开发价值。
(9)和美药业PDE4抑制剂莫米司特片获批上市
10月11日,国家药监局网站显示,赣州和美药业的莫米司特片获批上市。
公开资料显示,莫米司特是一种小分子选择性的PDE4抑制剂,主要用于治疗中度至重度斑块状银屑病,成为首款获批的国产PDE4抑制剂。
作为PDE家族的一员,PDE抑制剂是一种作用于靶细胞中特定PDE的药物,通过升高细胞内的cAMP和/或cGMP水平,激活蛋白激酶A/G,促进下游效应蛋白磷酸化,从而在多种炎症相关疾病中显示出显著疗效。
目前,研究人员正在开发PDE4抑制剂用于治疗多种炎症性疾病,包括银屑病、强直性脊柱炎、特应性皮炎、类风湿关节炎、系统性红斑狼疮等等。
(10)优时比的重症肌无力新药泽卢克布仑钠在华获批上市
10 月 11 日,全球生物制药公司优时比(UCB)宣布,中国国家药品监督管理局(NMPA)已批准泽卢克布仑钠注射液上市,与常规治疗药物联合用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。
此次获批使泽卢克布仑钠成为全球首个且唯一可通过皮下注射、患者可自行给药的新一代C5补体抑制剂,为中国gMG患者带来更便捷的治疗选择。
泽卢克布仑钠是一款具备双重抑制作用的新一代C5补体抑制剂。在AChR抗体阳性的gMG患者体内,异常抗体会激活免疫系统补体反应,最终在神经-肌肉接头处形成“攻膜复合物(MAC)”,破坏神经肌肉信号传递、导致肌肉无力;而泽卢克布仑钠可有效阻断补体介导的神经肌肉接头损伤,从发病机制层面干预疾病进展。从给药方式来看,泽卢克布仑钠实现了突破性创新:患者在家中仅需5-8秒即可完成皮下注射,无需频繁往返医院,既减轻了就医负担,也帮助患者在疾病管理中获得更大的便利性与独立性。
1.4.2 本期全球TOP10积极/失败临床结果
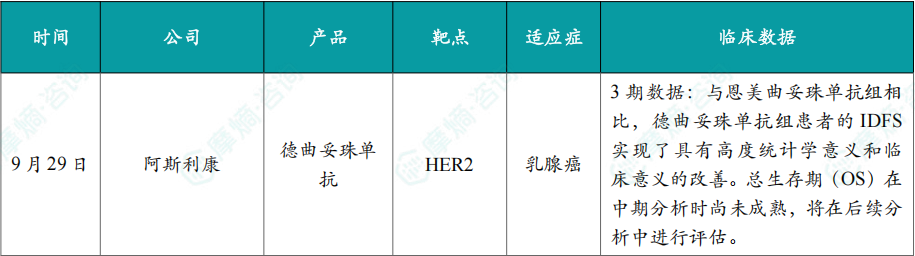
(1)阿斯利康的德曲妥珠单抗辅助治疗乳腺癌3期研究成功
9月29日,阿斯利康宣布Enhertu(德曲妥珠单抗)辅助治疗高危HER2阳性早期乳腺癌的III期DESTINY-Breast05研究在中期分析中取得了积极的高阳性结果。值得一提的是,今年早些时候,德曲妥珠单抗新辅助治疗HER2阳性乳腺癌的III期DESTINY-Breast11研究也取得了积极结果。
DESTINY-Breast05研究是一项全球性、多中心、随机、开放标签III期临床试验(n=1635),旨在评估德曲妥珠单抗(5.4mg/kg)对比恩美曲妥珠单抗(3.6mg/kg)辅助治疗在新辅助治疗后复发风险高且乳腺或腋下淋巴结有残留浸润性疾病的HER2阳性原发性乳腺癌患者的疗效和安全性。
结果显示,与恩美曲妥珠单抗组相比,德曲妥珠单抗组患者的IDFS实现了具有高度统计学意义和临床意义的改善。总生存期(OS)在中期分析时尚未成熟,将在后续分析中进行评估。
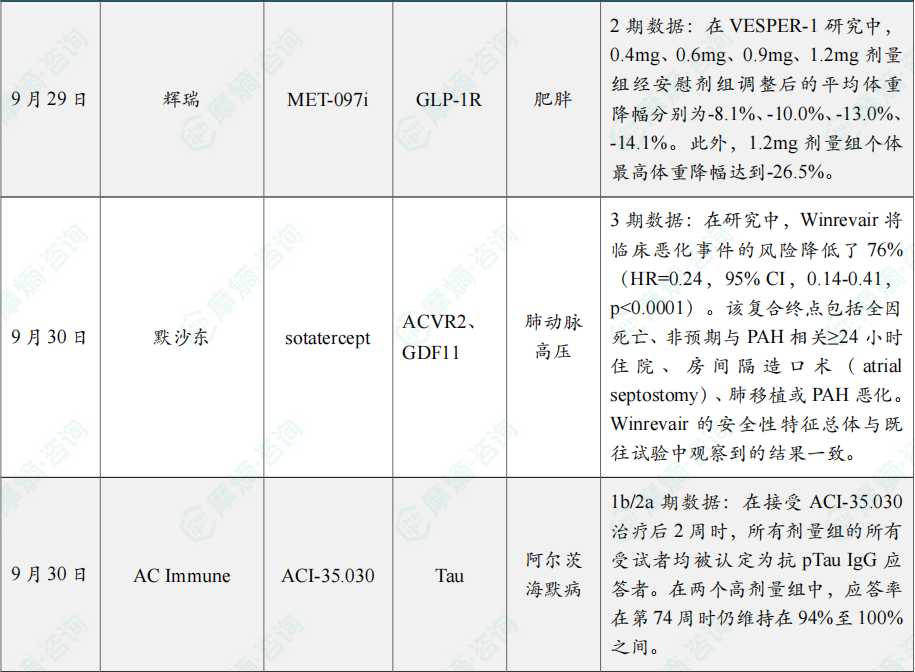
(2)辉瑞超长效GLP-1两项减重2期研究取得积极结果
9月29日,Metsera(已被辉瑞收购)宣布 MET-097i 的两项减重IIb期研究(VESPER-1和VESPER-13)取得了积极结果。
MET-097i 是一种同类首创的完全偏向、超长效GLP-1受体激动剂(GLP-1-RA),具有每月注射1次的给药潜力。VESPER-1研究(n=239)评估了MET-097i(0.4mg-1.2mg,每周1次)的减重疗效和安全性,研究持续28周,无需滴定。目前正在进行研究扩展,并评估较低注射频率的效果。VESPER-3研究是一项正在进行的临床试验,共纳入了268例超重或肥胖受试者,旨在评估每月多次 MET-097i 的疗效和耐受性,并在12周的中期分析时评估多种剂量递增策略的耐受性,研究共持续28周。
在VESPER-1研究中,0.4mg、0.6mg、0.9mg、1.2mg剂量组经安慰剂组调整后的平均体重降幅分别为-8.1%、-10.0%、-13.0%、-14.1%。此外,1.2mg剂量组个体最高体重降幅达到-26.5%。VESPER-3研究正在进行中,尚无减重数据可分享。
(3)默沙东的sotatercept 3期临床取得积极结果
9月30日,默沙东(MSD)宣布,3期临床试验HYPERION取得积极结果。该试验评估了Winrevair(sotatercept)对比安慰剂(两组均联合基础治疗)在新近确诊的肺动脉高压(PAH)成人患者中的疗效,患者功能分级(FC)为II或III,且具有中度或高度疾病进展风险。
在研究中,Winrevair将临床恶化事件的风险降低了76%(HR=0.24,95% CI,0.14-0.41,p<0.0001)。该复合终点包括全因死亡、非预期与PAH相关≥24小时住院、房间隔造口术(atrial septostomy)、肺移植或PAH恶化。Winrevair的安全性特征总体与既往试验中观察到的结果一致。该研究结果已在2025年欧洲呼吸学会(ERS)大会上公布,并同步发表于《新英格兰医学杂志》。
在HYPERION研究中,Kaplan-Meier曲线早期即出现分离,随机化后6周内即可观察到治疗获益。结果显示,接受Winrevair治疗的患者中有10.6%(n=17/160)发生至少一次临床恶化事件,而安慰剂组该比例为36.9%(n=59/160)。在所有预先设定的亚组中,Winrevair均展现一致的治疗效果,包括特发性PAH患者、合并结缔组织疾病的患者、接受双重基础治疗的患者、接受三重基础治疗的患者,以及基于REVEAL Lite 2和COMPERA 2.0风险评估工具判定为中度或中低度风险的患者。
(4)AC Immune公司公布阿尔茨海默病疗法ACI-35.030的1b/2a期临床试验结果
9月30日,AC Immune公司公布了其用于治疗阿尔茨海默病的免疫疗法 ACI-35.030 的1b/2a期临床试验结果。ACI-35.030基于AC Immune的SupraAntigen技术平台开发,该技术将pTau肽锚定在脂质体中,同时包含非Tau T细胞表位和佐剂。试验还研究了另一种免疫疗法JACI-35.054,两种疗法针对同一靶点。
临床数据显示,针对同一靶点的两种不同主动免疫疗法制剂,能在早期阿尔茨海默病患者体内诱导产生有差异的抗体反应。安全性方面,ACI-35.030 和 JACI-35.054 均未报告任何具有临床意义的安全性或耐受性问题。ACI-35.030 仅需一次注射即可使所有受试者产生抗pTau IgG抗体滴度,并在后续接种中持续提升抗体水平。在接受 ACI-35.030 治疗后2周时,所有剂量组的所有受试者均被认定为抗pTau IgG应答者。在两个高剂量组中,应答率在第74周时仍维持在94%至100%之间。
目前,ACI-35.030已被选中推进至关键性2b期ReTain临床试验,用于治疗临床前期阶段的阿尔茨海默病。
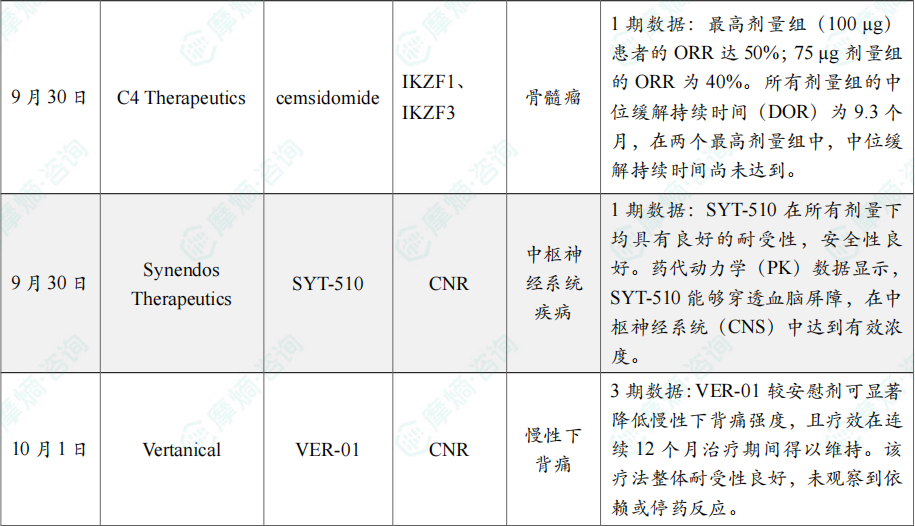
(5)C4 Therapeutics公司公布cemsidomide联合疗法1期临床试验数据
9月30日,C4 Therapeutics公司公布了其在研口服小分子IKZF1/3蛋白降解剂 cemsidomide 联合地塞米松治疗复发/难治性多发性骨髓瘤的1期临床试验数据。
截至2025年7月23日的数据,在接受过多线治疗的RRMM患者中,cemsidomide联合地塞米松展现出强劲且持久的抗肿瘤活性。最高剂量组(100 µg)患者的ORR达50%;75 µg剂量组的ORR为40%。所有剂量组的中位缓解持续时间(DOR)为9.3个月,在两个最高剂量组中,中位缓解持续时间尚未达到。
药效学(PD)结果显示,cemsidomide与地塞米松联用可高效降解靶蛋白并激活T细胞,在人外周血单核细胞中,IKZF1的降解率>50%、IKZF3降解率>80%,且在所有剂量下均显著增强T细胞活化和IL-2等细胞因子的产生,展现出与地塞米松联用或与地塞米松+BCMA双特异性T细胞衔接器(BCMA BiTE)联用的潜力。安全性方面,没有与cemsidomide相关的停药事件,且很少有剂量减少事件(6%),为其在联合治疗方案中的广泛应用提供了有力支持。
(6)Synendos Therapeutics公司公布SYT-510 1期临床试验积极结果
9月30日,Synendos Therapeutics公司公布了其核心候选药物 SYT-510 在健康受试者中开展的1期临床试验的积极结果。SYT-510 靶向内源性大麻素系统(ECS)中一个新近发现的靶点,属于新型ECS调节剂——选择性内源性大麻素再摄取抑制剂(SERIs)类别。
研究结果表明,SYT-510 在所有剂量下均具有良好的耐受性,安全性良好。药代动力学(PK)数据显示,SYT-510 能够穿透血脑屏障,在中枢神经系统(CNS)中达到有效浓度。该药物展现出明确的脑部药效学作用,其对脑电图(EEG)的影响与成功用于控制焦虑症状的抗焦虑药物一致。
(7)Vertanical公司公布其在研疗法VER-01 3期临床试验积极结果
10月1日,Vertanical宣布,两项评估其在研疗法 VER-01 在慢性下背痛(CLBP)治疗中安全性与有效性的3期临床研究结果已发表于Nature Medicine和Pain & Therapy期刊。VER-01 为一款潜在“first-in-class”、大麻(Cannabis sativa)的标准化全谱系提取物。
分析显示,VER-01较安慰剂可显著降低慢性下背痛强度,且疗效在连续12个月治疗期间得以维持。该疗法整体耐受性良好,未观察到依赖或停药反应。在另一项与阿片类药物的3期头对头研究中,VER-01在镇痛效果及胃肠道耐受性方面均优于阿片类药物,且未见依赖或滥用迹象。同时,VER-01还能改善慢性疼痛常伴随的关键症状,包括睡眠障碍与体能受损,从而显著提升患者生活质量。
Vertanical已在多个欧洲国家提交VER-01的上市许可申请,并计划于2026年初在美国启动3期研究,以支持后续向FDA递交上市申请。
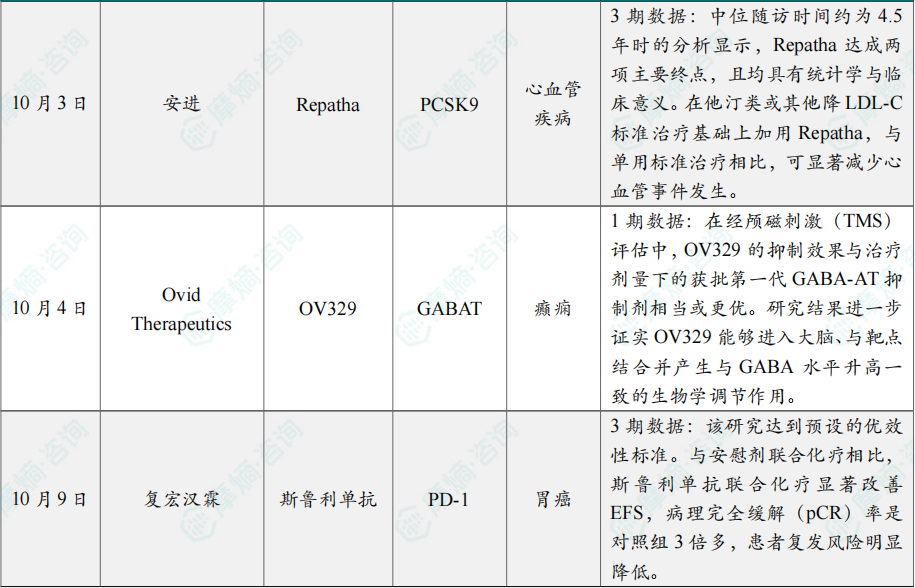
(8)安进降脂单抗Repatha 3期临床结果积极
10月3日,安进(Amgen)宣布,VESALIUS-CV临床3期试验达到双主要终点,结果显示在既往无心肌梗死或卒中病史的人群中,Repatha(evolocumab)可显著降低主要不良心血管事件(MACE)风险。
根据新闻稿,Repatha是首个同时在一级与二级预防中证实可显著降低心血管事件发生的PCSK9抑制剂。VESALIUS-CV是一项双盲、随机、安慰剂对照的全球临床3期试验,旨在评估在无既往心肌梗死或卒中病史、但具高心血管风险的成人中,Repatha通过降低低密度脂蛋白胆固醇(LDL-C)对MACE的影响。
该研究入组了逾1.2万名受试者,试验的双主要终点为首次发生复合终点事件的时间;以及首次发生另一复合终点的时间。中位随访时间约为4.5年时的分析显示,Repatha达成两项主要终点,且均具有统计学与临床意义。在他汀类或其他降LDL-C标准治疗基础上加用Repatha,与单用标准治疗相比,可显著减少心血管事件发生。
(9)Ovid Therapeutic公布癫痫疗法OV329的1期临床积极结果
10月4日,Ovid Therapeutics宣布,其下一代GABA-氨基转移酶(GABA-AT)抑制剂 OV329 在健康受试者中开展的1期研究获得积极顶线结果。根据此结果,Ovid计划将OV329推进至难治性局灶性癫痫发作(FOS)的2a期研究。
生物标志物研究显示,OV329 在多项指标上实现了对GABA-AT的统计学显著抑制;在经颅磁刺激(TMS)评估中,OV329 的抑制效果与治疗剂量下的获批第一代GABA-AT抑制剂相当或更优。研究结果进一步证实 OV329 能够进入大脑、与靶点结合并产生与GABA水平升高一致的生物学调节作用。安全性与耐受性数据相较获批抗癫痫药物(ASM)表现更佳。
OV329为一款下一代、潜在“best-in-class”GABA-AT抑制剂,旨在治疗包括癫痫持续状态相关发作、结节性硬化症、婴儿痉挛症以及局灶性癫痫发作等罕见与难治性癫痫。鉴于低水平的GABA与神经元高兴奋性相关,OV329 被认为通过降低GABA-AT活性以提升脑内GABA水平,从而有望抑制导致发作的高兴奋性。
(10)复宏汉霖创新药斯鲁利单抗胃癌3期临床达主要终点
10月9日,复宏汉霖宣布,该公司自研创新型PD-1抑制剂H药斯鲁利单抗联合化疗新辅助/单药辅助治疗胃癌的3期临床研究(ASTRUM-006)期中分析达到了主要研究终点无事件生存期(EFS)。根据新闻稿,该治疗方案成为胃癌围术期(术前/术后)以免疫单药取代术后辅助化疗的治疗方案,实现了该领域的重要突破。
ASTRUM-006 是一项针对早期胃癌患者的随机、双盲、多中心的3期临床研究,旨在评估斯鲁利单抗联合化疗对比安慰剂联合化疗新辅助/单药辅助治疗早期胃癌患者的临床有效性及安全性。
根据独立数据监察委员会(IDMC)的期中分析结果显示:该研究达到预设的优效性标准。与安慰剂联合化疗相比,斯鲁利单抗联合化疗显著改善EFS,病理完全缓解(pCR)率是对照组3倍多,患者复发风险明显降低。同时,该治疗方案安全性良好,未发现新的安全性信号。基于这一积极结果,建议提前申报上市。
同期事件:
1. 2025年第40-41周09.29-10.12国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第40-41周09.29-10.12国内仿制药/生物类似物申报/审批数据分析
3. 2025年第40-41周09.29-10.12国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.29-2025.10.12) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论