
回顾 2024 年,细胞和基因疗法(CGT)领域可谓是波澜壮阔,在取得诸多突破的同时,也面临着部分疗法受挫的情况。
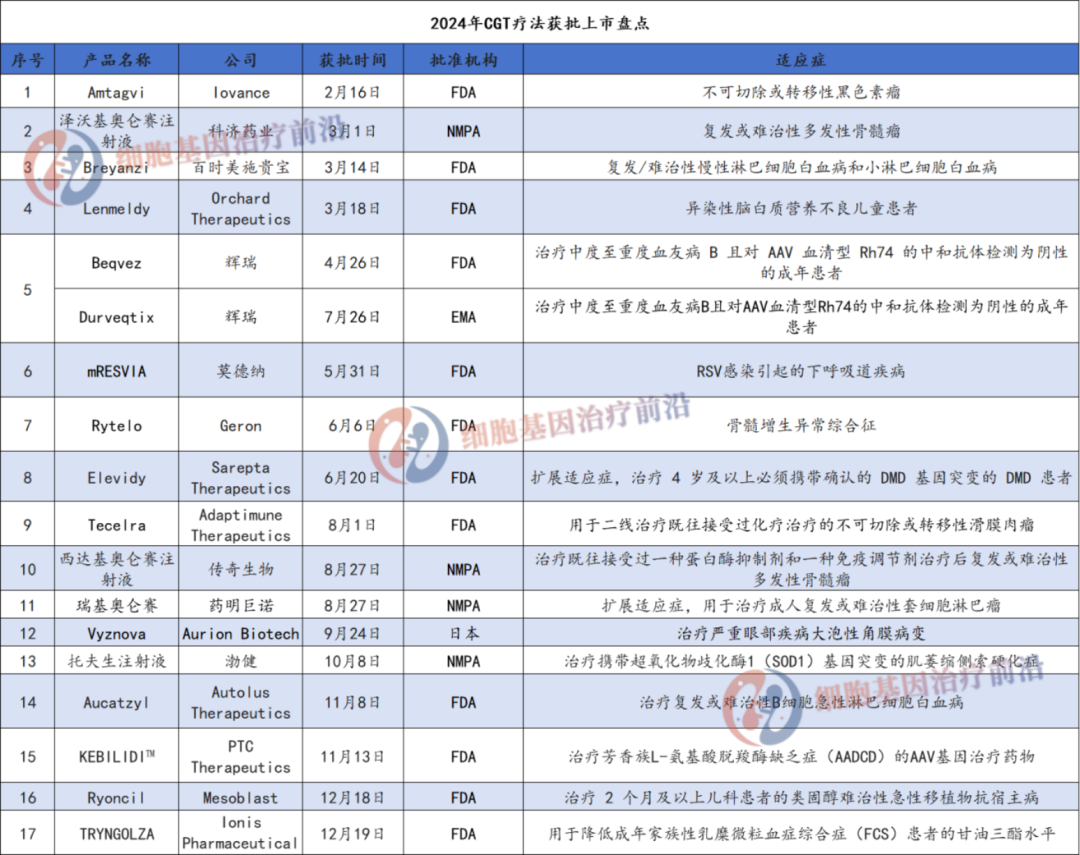
据不完全统计,2024年全球有17款 CGT 疗法获批上市。当然也有一部分CGT疗法遭遇挫折,或被拒批,或延迟审批或临床试验被迫终止。例如,一些企业的 CGT 产品由于在临床试验中未能达到预期的疗效终点,或者出现了安全性问题,导致审批受阻。还有部分产品因生产工艺复杂、质量控制难度大等问题,无法满足监管部门的要求,从而延迟了上市进程。具体如下:
1. 拒批
(1)EB-101
4月22日,Abeona Therapeutics 的细胞疗法prademagene zamikeracel (pz-cel,EB-101)上市申请遭拒,FDA 要求其提供治疗的有效信息及满足额外的 CMC 要求。
EB-101用于治疗隐性营养不良性大疱性表皮松解症患者。它是一款自体的细胞与基因治疗,使用逆转录病毒载体将COL7A1基因导入患者自身的皮肤细胞(角质形成细胞),并将其移植回患者体内,以使正常的VII型胶原蛋白表达和促进伤口愈合。
(2)Kresladi
6月28日,Rocket Pharmaceuticals 的基因疗法Kresladi™ (marnegragene autotemcel; marne-cel)被拒批,FDA 要求提供有限的额外化学制造和控制 (CMC) 信息以完成审查。
Kresladi(曾用名RP-L201)用于治疗严重白细胞粘附缺陷, 是一款用以治疗严重白细胞粘附缺陷-I(LAD-I)的在研基因疗法,该疗法通过慢病毒对患者的自体造血干细胞进行基因工程化改造,以递送ITGB2基因的功能性拷贝。
2. 延迟
(1)Ryoncil
Mesoblast 的间充质干细胞疗法 Ryoncil 在审批过程中历经波折,曾收到 2 封 CRL(申请拒绝),直到 2024 年 12 月 18 日才获批上市,用于治疗激素难治性急性移植物抗宿主病。
3. 暂停或终止
(1)vx-880
1月7日,因两名患者死亡,Vertex 暂停细胞疗法 vx-880 的临床试验,等待独立数据监控委员会和全球监管机构对全部数据的审查。vx-880 是一种干细胞衍生的胰岛细胞疗法,用于治疗 1 型糖尿病。
(2)Posoleucel
1月上旬,AlloVir宣布终止核心产品Posoleucel 的三项3期临床试验。Posoleucel是一种实验性的多病毒特异性T细胞疗法,AlloVir停止的3项临床试验,分别是用于预防多种病毒引起的感染或疾病,治疗病毒相关的出血性膀胱炎(vHC)和治疗腺病毒(AdV)。
(3)fordadistrogene movaparvovec
5月7日,一名杜氏肌营养不良患者在使用辉瑞的基因疗法 fordadistrogene movaparvovec的 2 期临床试验中去世,死因是心脏骤停。辉瑞随后暂停了其针对 4 到 8 岁男孩的随机、安慰剂对照 3 期试验 CIFFREO 中的患者交叉试验。两个月后,辉瑞宣布 3 期 CIFFREO 研究未达到主要终点,也未达到关键次要终点,决定终止开发这款产品。
(4)giroctocogene fitelparvovec
12月30日,辉瑞宣布终止与 Sangamo 在 A 型血友病基因疗法 giroctocogenefitelparvovec上的合作。辉瑞经多方统筹分析,认为目前患者对额外基因治疗选择的兴趣非常有限。
(5)spk-3006
spk-3006是由罗氏子公司 Spark Therapeutics 开发的一种肝靶向的 AAV 试验性基因疗法,用于治疗庞贝病。在罗氏 2024 年上半年的管线梳理中,决定剔除该项目,停止了对其的临床开发。停止试验的决定不是由于安全问题,而是作为 Spark 内部战略组合优先级的一部分做出的。
(6)GLPG5301
Galapagos公司研发的一款 BCMA CAR-T 疗法 GLPG5301,主要用于治疗成人复发 / 难治性多发性骨髓瘤。因一名患者出现帕金森综合症而在 2024 年 8 月暂停所有临床。不过好在经过审查和采取额外的安全措施后,已于 2024 年第三季度恢复招募。
4. 退出
(1)Alofisel(Darvadstrocel)
Alofisel是一种同种异体间充质干细胞疗法,于2018年在欧盟获批,用于治疗对至少一种常规或生物疗法无效的非活动性/轻度活动性管腔克罗恩病的成人患者的复杂肛周瘘。然而,12月13日,武田制药公司宣布自愿撤销Alofisel在欧盟的营销授权。这一决定是基于补充临床试验结果,显示该药物未能达成主要和次要终点,且疗效不如预期。
回顾2024年FDA对这些 CGT 疗法的审批动态,无论是获批上市、拒绝还是延迟,都深刻影响着患者的治疗希望、企业的发展命运以及整个行业的未来走向。审批过程中的种种要求与决策,不仅是对疗法安全性和有效性的严格把关,更是推动 CGT 领域朝着更加规范、成熟方向发展的重要力量。
参考资料:公开资料
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论