
近日,华东医药全资子公司杭州中美华东制药有限公司(以下简称“中美华东”) 和重庆派金生物科技有限公司(以下简称“重庆派金”)共同开展的司美格鲁肽注射液Ⅲ期临床试验完成首例受试者入组及给药。

该研究是一项多中心、随机、开放、平行对照的III期临床研究,主要目的是在二甲双胍治疗后血糖控制不佳的2型糖尿病患者中论证试验药物司美格鲁肽注射液与对照药物司美格鲁肽注射液(诺和泰®)在治疗32周后血糖控制的等效性。本次Ⅲ期研究计划在全国50多家临床研究中心共同开展,入组不少于496例成人2型糖尿病受试者,预计2024年上半年完成全部受试者入组。
司美格鲁肽注射液是一种长效胰高血糖素样肽-1(GLP-1)受体激动剂,与人GLP-1有94%的序列同源性,临床上主要用于2型糖尿病患者的血糖控制,在国外也被获批用于肥胖或体重超重患者的治疗。
司美格鲁肽注射液的原研企业为诺和诺德(Novo Nordisk A/S),其糖尿病适应症于2017年12月获美国食品药品管理局(FDA)批准上市, 2018年2月获欧洲药品管理局(EMA)批准,商品名:Ozempic®,2021年4月获得中国国家药品监督管理局(NMPA)批准,商品名:诺和泰®。原研司美格鲁肽注射液的肥胖或超重适应症于2021年6月获FDA批准,2022年1月获得EMA批准,商品名:Wegovy®。
司美格鲁肽特殊审批
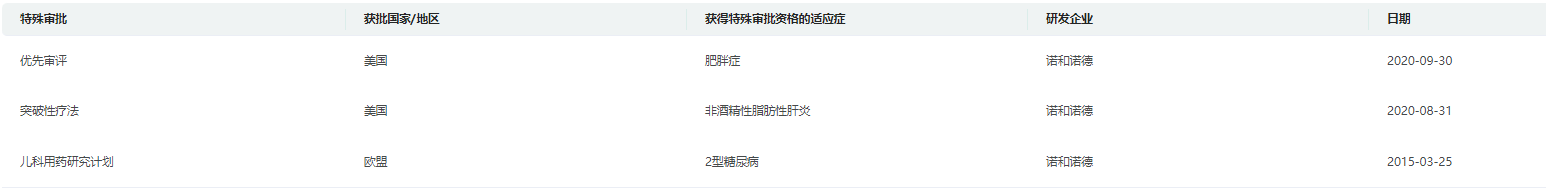
截图来源:药融云全球药物研发数据库
司美格鲁肽为GLP-1受体激动剂,GLP-1类产品具有减肥、降糖和心血管获益等功效,是相对成熟稳定和安全的靶点。后续司美格鲁肽注射液也计划在国内启动用于肥胖或超重适应症的临床试验。该公司在减肥领域围绕GLP-1靶点进行了差异化布局,已构筑包括口服、注射剂在内的长效及多靶点全球创新药和生物类似药相结合的全方位产品管线:利拉鲁肽注射液是国内首个获批肥胖或超重适应症的GLP-1产品;目前在研的还包括生物类似药司美格鲁肽注射液、全球创新口服小分子GLP-1受体激动剂HDM1002、双靶点激动剂HDM1005及SCO-094、长效三靶点激动剂DR10624等多款产品。
2022年6月29日,由中美华东、重庆派金申报的司美格鲁肽注射液临床试验申请获得批准。本次司美格鲁肽注射液在中国的Ⅲ期临床试验完成首例受试者入组,是该款产品研发过程中的又一重要里程碑事件。
关于华东医药
华东医药股份有限公司(证券代码:000963)创建于1993年,总部位于浙江杭州,于1999年12月在深圳证券交易所上市。历经20余年的发展,公司业务覆盖医药全产业链,以医药工业为主导,同时拓展医药商业、医美产业和工业微生物业务,已发展成为集医药研发、生产、经销为一体的大型综合性医药上市公司。2023年一季度实现营业收入(含CSO业务)30.75亿元,同比增长10.19%;实现合并扣非归母净利润6.67亿元,同比增长15.90%,环比2022年第四季度增长39.98%。
参考资料:
1.华东医药
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论