1.4.1本周全球TOP10创新药研发进展
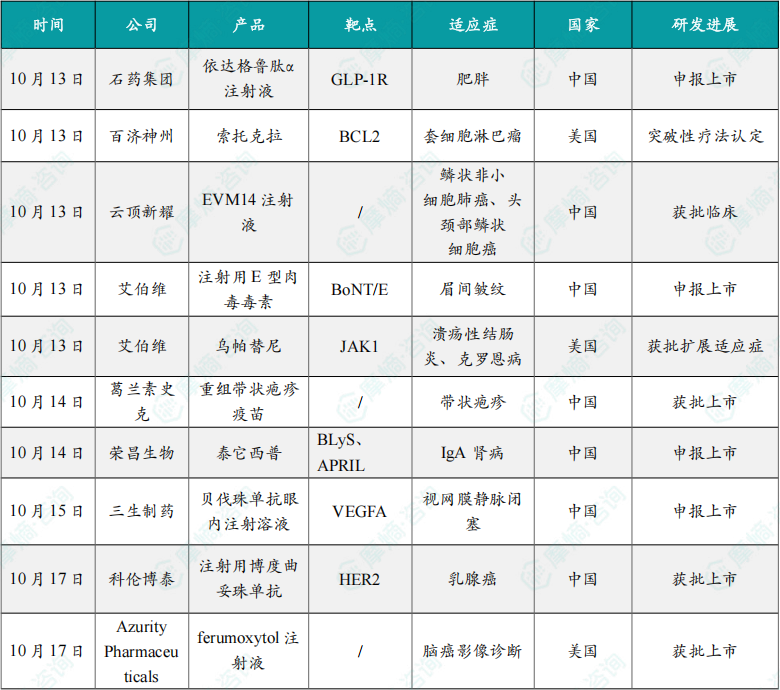
(1)石药集团1类减重创新药依达格鲁肽α注射液申报上市
10月13日,石药集团宣布,该公司附属公司石药集团百克生物开发的依达格鲁肽α注射液的新药上市申请已获中国NMPA受理。这是一款重组人源胰高血糖素样肽-1(hGLP-1)Fc融合蛋白注射液,患者每周需使用一次。该产品按照治疗用生物制品1类新药申报,其适应症为在控制饮食和增加运动的基础上,用于超重或肥胖成人的长期体重管理。
据石药集团公告介绍,依达格鲁肽α注射液可以选择性结合并激活GLP-1受体,通过抑制食欲、减少食物摄入等机制达到降低体重的效果,还可以实现葡萄糖浓度依赖性地降低血糖,并改善心血管及代谢等指标。目前,该产品在2型糖尿病患者中开展的两项3期临床试验正在积极推进中,以期使更多患者从中获益。
(2)百济神州Bcl2抑制剂索托克拉获美国FDA突破性疗法认定
10月13日,百济神州宣布,美国食品药品监督管理局(FDA)已授予索托克拉(一款新一代且具有同类最优潜力的在研BCL2抑制剂)突破性疗法认定(BTD),用于治疗复发或难治性(R/R)套细胞淋巴瘤(MCL)成人患者。
此外,FDA已接受百济神州参加Orbis计划的申请。在该计划的框架下,抗肿瘤药物可向参与的全球卫生管理部门同时递交申请并接受审评。
该决定基于BGB-11417-201的研究数据。BGB-11417-201是一项在接受过布鲁顿酪氨酸激酶抑制剂(BTKi)和抗CD20疗法治疗的R/R MCL成人患者中评价索托克拉治疗的1/2期研究。该研究近期公布的积极结果显示索托克拉有潜力提供深度和持久的缓解,有望成为首款且唯一一款在美国获批治疗R/R MCL的BCL2抑制剂。百济神州计划在即将召开的医学大会上展示该研究的完整数据。
(3)云顶新耀肿瘤治疗性疫苗EVM14注射液获批临床
10月13日,云顶新耀宣布,其通用现货型肿瘤治疗性疫苗EVM14注射液的新药临床试验申请(IND)获国家药品监督管理局批准。EVM14成为公司首个实现中国国家药品监督管理局(NMPA)和美国食品药品监督管理局(FDA)IND双获批的mRNA肿瘤治疗性疫苗。
EVM14基于云顶新耀自主知识产权的mRNA技术平台研发,是一款靶向5个肿瘤相关抗原(TAA)的通用现货型肿瘤治疗性疫苗,拟用于治疗多种鳞状细胞癌,包括非小细胞肺鳞癌(sq-NSCLC)和头颈部鳞状细胞癌(HNSCC)。此前,EVM14新药临床试验申请于2025年3月获美国食品药品监督管理局批准。
(4)艾伯维1类除皱新药国内申报上市
10月13日,中国国家药品监督管理局药品审评中心(CDE)官网显示,艾伯维(AbbVie)的注射用E型肉毒毒素TrenibotE上市申请已获受理。根据公开资料和临床试验进展,推测适应症为中度至重度眉间纹。这一消息标志着在医疗美容领域,尤其是除皱治疗方面,可能迎来一项新的突破性疗法。
TrenibotE是由艾伯维开发的一种新型E型肉毒神经毒素,是全球首个进入上市申请阶段的E型肉毒毒素。与目前市场上广泛使用的A型肉毒毒素相比,TrenibotE在作用机制和临床表现上具有显著差异。
作为一种神经毒素,TrenibotE通过抑制神经末梢释放乙酰胆碱,减少肌肉收缩,从而达到除皱的效果。与A型肉毒毒素相比,TrenibotE(E型)因其作用于不同的底物蛋白且在神经末梢的代谢速率更快,因此表现出起效迅速(数小时内)和作用持续时间较短(2-3周)的特点。这为患者提供了更灵活的治疗选择,减少了长时间肌无力带来的不便。
(5)艾伯维的乌帕替尼获FDA批准扩展适应症
10月13日,艾伯维宣布,美国FDA批准了一项补充新药申请(sNDA),该申请更新了JAK抑制剂RINVOQ(乌帕替尼、upadacitinib)的适应症声明,用于治疗患有中度至重度活动性溃疡性结肠炎(UC)和中度至重度活动性克罗恩病(CD)的成人。
此前,RINVOQ 适用于对一种或多种肿瘤坏死因子(TNF)阻滞剂反应不足或不耐受的中度至重度活动性UC或CD成人。此次标签更新赋予医疗专业人员更大的灵活性,当TNF阻滞剂在临床上不可取时,他们可以在早期阶段为在接受至少一种批准的全身治疗后的患者选择Rinvoq,从而优化个体化治疗策略。
(6)GSK重组带状疱疹疫苗在中国获批新适应症
10月14日,葛兰素史克(GSK)宣布,中国国家药品监督管理局(NMPA)已批准欣安立适——葛兰素史克重组带状疱疹疫苗(CHO细胞)(简称RZV)用于18岁及以上因已知疾病或治疗(如自体造血干细胞移植)造成免疫缺陷或免疫抑制从而导致带状疱疹发病风险增加的成人预防带状疱疹。
根据新闻稿介绍,此次获批是基于此前针对50岁及以上成人适应症的扩展。此次获批扩大了欣安立适的适用范围,以确保为带状疱疹发病风险增加人群提供防护。
欣安立适是一种非活性重组亚单位疫苗,适用于预防50岁及以上成人带状疱疹,在部分国家/地区,该疫苗也已获批用于18岁及以上带状疱疹风险增加的成人。该疫苗由糖蛋白E抗原与AS01B佐剂系统组成,有助于克服随因年龄增长而出现的免疫应答下降问题,从而保护50岁及以上成人免受带状疱疹侵袭。
(7)荣昌生物的泰它西普IgA肾病新适应症申报上市
10月14日,CDE官网显示,荣昌生物自主研发的全球首创BLyS/APRIL双靶点融合蛋白创新药泰它西普申报新适应症,推测此次申报用于治疗具有进展风险的原发性免疫球蛋白A(IgA)肾病成人患者,显著降低蛋白尿水平,此前该适应症已被纳入优先审评。
今年8月,泰它西普治疗原发性IgA肾病的国内III期临床研究达到A阶段的主要研究终点。研究结果显示,与安慰剂组相比,泰它西普组患者在治疗39周时24小时尿蛋白肌酐比值(UPCR)降低了55%(P<0.0001),且表现出良好的耐受性和安全性。泰它西普是目前唯一可同时抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)的药物,而这两种细胞因子在IgA肾病患者中的水平显著高于正常人群,是疾病发生的关键驱动因素。通过抑制这两种因子,泰它西普可减少B细胞增殖、降低浆细胞数量及异常免疫球蛋白生成,从源头阻断免疫复合物沉积,减轻肾脏免疫炎症反应。
(8)三生制药眼科创新药贝伐珠单抗眼内注射溶液申报上市
10月15日,三生制药宣布601A(SSGJ-601,通用名:贝伐珠单抗眼内注射溶液)的首个上市申请已获国家药监局受理,用于视网膜分支静脉阻塞(BRVO)所致黄斑水肿病变。601A是三生制药自主研发的一款重组抗血管内皮生长因子(VEGF)人源化单抗。
VEGF是刺激脉络膜和视网膜新生血管形成的重要因子,同时还会导致血管通透性的增加,从而导致黄斑水肿。因此,抗VEGF治疗成为治疗黄斑水肿的重要靶点。601A已顺利完成针对BRVO的III期临床研究。结果显示,患者经601A治疗24周后,最佳矫正视力(BCVA)较基线的改善效果非劣于雷珠单抗。安全性方面,601A治疗后总体安全性和耐受性良好,整体获益风险正向。
(9)科伦博泰1类新药注射用博度曲妥珠单抗获批上市
10月17日,国家药品监督管理局(NMPA)官网显示,科伦博泰的注射用博度曲妥珠单抗(商品名:舒泰莱)获批上市,用于既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
博度曲妥珠单抗是科伦博泰研发的创新HER2 ADC,其通过稳定酶可裂解连接子将新型MMAF衍生物(高细胞毒性微管蛋白抑制剂Duo-5)与HER2单克隆抗体偶联,药物抗体比(DAR)为2。博度曲妥珠单抗特异性结合肿瘤细胞表面的HER2,并被肿瘤细胞内吞,在胞内释放毒素分子Duo-5,Duo-5诱导肿瘤细胞周期阻滞在G2/M期,引起肿瘤细胞凋亡。博度曲妥珠单抗靶向结合HER2后也可抑制HER2介的信号通路:其具有抗体依赖细胞介导细胞毒作用(ADCC)活性。
(10)FDA批准新型显影剂,适用脑癌患者
10月17日,Azurity Pharmaceuticals宣布,美国FDA已批准Ferabright(ferumoxytol注射液)上市。
根据新闻稿,Ferabright为适用于对已知或疑似脑部恶性肿瘤的成年患者进行脑部磁共振成像(MRI),用于可视化血脑屏障受损病灶的首个基于铁的显影剂。在临床试验中,与增强前成像相比,使用Ferabright增强的MRI显著提升了原发性和继发性脑肿瘤的可视化效果。除成像质量提升外,Ferabright还因其较长的半衰期可提供更长的成像窗口,支持灵活的MRI成像方案,无需多次注射显影剂。
作为铁基显影剂,Ferabright经人体天然的铁代谢通路处理,有望降低与其他显影剂相关的长期滞留顾虑。此外,与许多其他显影剂不同,Ferabright适用于肾功能不全患者,使其在减少暴露于其他显影剂中重金属的同时,亦可接受增强MRI检查。
1.4.2 本周全球TOP10积极/失败临床结果
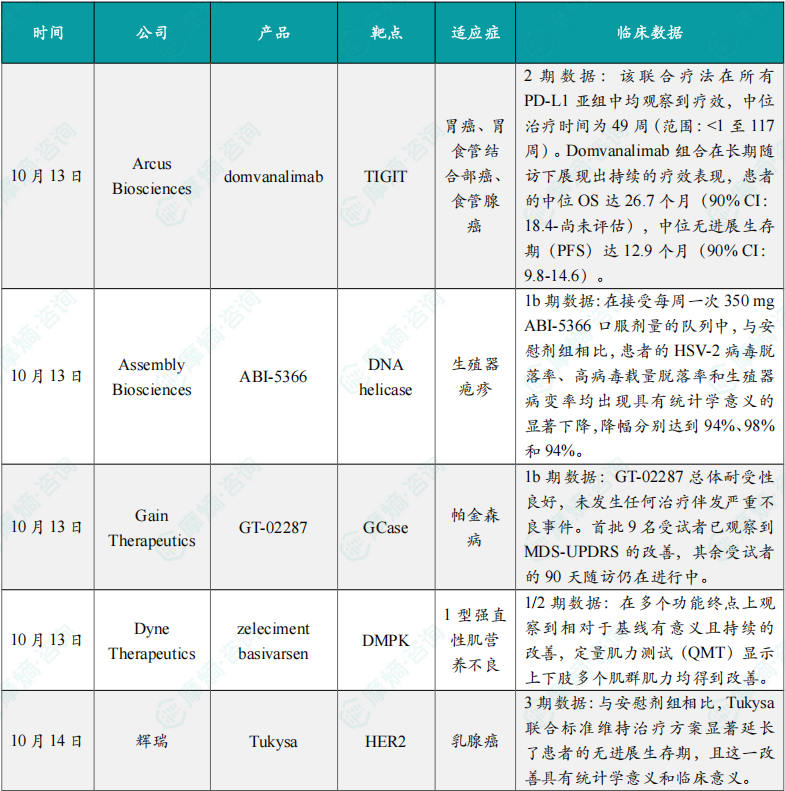
(1)Arcus公司公布TIGIT抗体组合疗法2期临床积极结果
10月13日,Arcus Biosciences公布其2期EDGE-Gastric研究A1队列的首个总生存期(OS)结果,针对局部晚期、不可切除或转移性胃癌、胃食管结合部癌及食管腺癌患者。
EDGE-Gastric是一项多队列的全球性2期研究,旨在评估Fc失活型抗TIGIT抗体domvanalimab联合抗PD-1单抗zimberelimab及化疗,作为一线治疗的疗效和安全性。
本研究与吉利德公司合作开展,截至2025年3月3日,共有41例患者入组并接受治疗,中位随访时间为26.4个月。结果显示,该联合疗法在所有PD-L1亚组中均观察到疗效,中位治疗时间为49周(范围:<1至117周)。Domvanalimab组合在长期随访下展现出持续的疗效表现,患者的中位OS达26.7个月(90% CI:18.4-尚未评估),中位无进展生存期(PFS)达12.9个月(90% CI:9.8-14.6)。该研究结果支持在相同患者群体中继续推进3期STAR-221研究。
(2)Assembly Biosciences公司公布ABI-5366 1b期临床试验数据
10月13日,Assembly Biosciences公司公布了一种用于治疗复发性生殖器疱疹的长效解旋酶-引物酶抑制剂ABI-5366的1b期临床试验数据。该候选疗法通过靶向病毒解旋酶-引物酶复合体发挥作用。这是一种在HSV-1和HSV-2中都保守的重要病毒酶复合体,并且宿主细胞中没有类似的酶复合体。在短期临床研究中,HSV解旋酶-引物酶抑制剂显示出比核苷类似物更佳的疗效潜力。
此次公布的结果显示,在接受每周一次350 mg ABI-5366口服剂量的队列中,与安慰剂组相比,患者的HSV-2病毒脱落率、高病毒载量脱落率和生殖器病变率均出现具有统计学意义的显著下降,降幅分别达到94%、98%和94%。药代动力学特征支持ABI-5366采用每周甚至有望每月一次的给药方案。
(3)Gain Therapeutics公司公布GT-02287 1b期临床试验初步数据
10月13日,Gain Therapeutics公布了其用于治疗帕金森病的在研变构小分子GT-02287的1b期试验的初步数据。
GT-02287是一种口服变构蛋白调节剂,具有可穿越血脑屏障的能力。该药物可恢复溶酶体蛋白酶葡萄糖脑苷脂酶(GCase)的功能,该酶由于GBA1基因突变(与帕金森病相关的最常见遗传异常)或其他与年龄相关的压力因素而发生错误折叠和受损。
此次公布的结果显示,GT-02287总体耐受性良好,未发生任何治疗伴发严重不良事件。首批9名受试者已观察到MDS-UPDRS的改善,其余受试者的90天随访仍在进行中。患者的血浆药物暴露水平处于预期的治疗范围内,且与此前1期健康受试者研究中的暴露水平相当。
(4)Dyne Therapeutics公司公布zeleciment basivarsen 1/2期临床试验新数据
10月13日,Dyne Therapeutics公司公布了在研抗体偶联反义寡核苷酸疗法zeleciment basivarsen,在治疗强直性肌营养不良1型(DM1)患者的1/2期临床试验ACHIEVE中的新数据。DYNE-101由与抗体片段(Fab)偶联的反义寡核苷酸组成,Fab与肌肉上高表达的转铁蛋白受体1(TfR1)结合。它旨在实现靶向肌肉组织递送,目的是减少细胞核中的有毒DMPK基因的RNA,允许正常mRNA处理和正常蛋白翻译,并有可能阻止或逆转疾病进展。DYNE-101已被欧洲药品管理局(EMA)和美国FDA授予孤儿药资格,用于治疗DM1。
此次公布的结果显示,zeleciment basivarsen为患者提供了广泛的功能改善。通过视频手部张开时间(vHOT)测试显示,患者手部肌强直相对于基线有显著且持续的改善。在多个功能终点上观察到相对于基线有意义且持续的改善,包括10米步行/跑步测试(10MWR)和5次坐站测试(5xSTS)的结果,以及用于衡量上肢功能的9孔钉测试(9HPT)结果的改善。定量肌力测试(QMT)显示上下肢多个肌群肌力均得到改善,测试项目包括握力、屈肘、伸肘、踝背屈、屈膝、伸膝。患者报告的强直性营养不良健康指数(MDHI)结果显示在认知障碍、睡眠障碍、疲劳、沟通、情绪问题、疼痛及活动能力等多个指标上,相对于基线有有意义且持续的改善。此外,患者和临床医生对整体功能的印象相对于基线有所改善。安全性方面,该药物安全性良好,未发现严重治疗伴发不良事件。
(5)辉瑞的Tukysa 3期试验达主要终点,用于治疗乳腺癌
10月14日,辉瑞宣布HER2靶向酪氨酸激酶抑制剂Tukysa(tucatinib)在的三期临床达到主要终点。数据来自HER2CLIMB-05研究实验,评估了Tukysa作为一线维持疗法,用于HER2阳性转移性乳腺癌患者在接受标准诱导治疗并产生响应后的效果。
HER2CLIMB-05是一项随机、双盲、安慰剂对照的三期研究。患者在接受曲妥珠单抗、帕妥珠单抗和紫杉烷类药物的诱导治疗且病情未进展后,被随机分配接受Tukysa+曲妥珠单抗和帕妥珠单抗(n=326),或安慰剂+曲妥珠单抗和帕妥珠单抗(n=328)。主要终点为无进展生存期(PFS)。结果显示,与安慰剂组相比,Tukysa联合标准维持治疗方案显著延长了患者的无进展生存期,且这一改善具有统计学意义和临床意义。
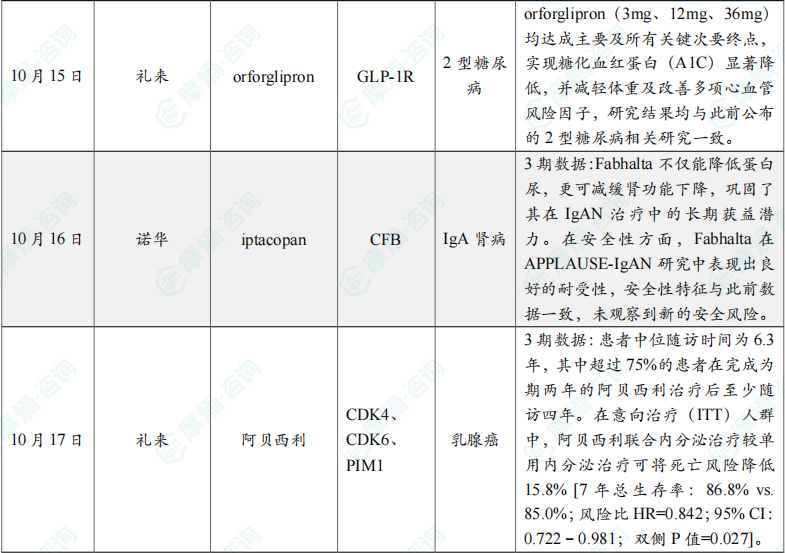
(6)礼来公布口服糖尿病药物orforglipron两项3期临床研究积极结果
10月15日,礼来公司(Eli Lilly and Company)公布了ACHIEVE-2与ACHIEVE-5两项3期临床试验的积极顶线结果。
ACHIEVE-2是该研究系列的第二项头对头对照研究,评估了orforglipron对比一款SGLT-2抑制剂在经二甲双胍治疗血糖控制不佳的2型糖尿病成人中的疗效。
ACHIEVE-5则评估了orforglipron对比安慰剂在经滴定甘精胰岛素治疗(联用或不联用二甲双胍和/或SGLT-2抑制剂)血糖控制不佳的2型糖尿病成人中的疗效。
两项研究在第40周时,在有效性估计目标和治疗方案估计目标下,orforglipron(3mg、12mg、36mg)均达成主要及所有关键次要终点,实现糖化血红蛋白(A1C)显著降低,并减轻体重及改善多项心血管风险因子,研究结果均与此前公布的2型糖尿病相关研究一致。
(7)诺华的伊普可泮3期临床研究达主要终点
10月16日,诺华宣布,其口服补体通路抑制剂Fabhalta(iptacopan)在针对成人IgA肾病(IgAN)患者的Ⅲ期临床研究APPLAUSE-IgAN中取得积极最终结果。研究显示,与安慰剂相比,Fabhalta在两年治疗期间显著减缓了估算肾小球滤过率(eGFR)的下降,结果具有统计学和临床意义,表明该药物可有效延缓肾功能衰退。
Fabhalta是一种作用于补体系统替代通路的口服因子B抑制剂。该药物早在2024年已获美国食品药品监督管理局(FDA)加速批准,用于降低成人IgA肾病患者的蛋白尿。该批准基于 APPLAUSE-IgAN的中期分析结果,当时数据显示,Fabhalta能在9个月内显著降低尿蛋白/肌酐比值(UPCR),其降幅明显优于安慰剂组。此次最终分析进一步证实,Fabhalta不仅能降低蛋白尿,更可减缓肾功能下降,巩固了其在IgAN治疗中的长期获益潜力。在安全性方面,Fabhalta在APPLAUSE-IgAN研究中表现出良好的耐受性,安全性特征与此前数据一致,未观察到新的安全风险。
(8)礼来公布阿贝西利早期乳腺癌3期研究长期OS结果
10月17日,礼来公司宣布,三期monarchE试验的总生存期(OS)主要分析结果显示,在激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)、淋巴结阳性、高危早期乳腺癌患者中,为期两年的阿贝西利联合内分泌治疗(ET)相较于单独使用ET,使患者死亡风险降低15.8%。此外,该治疗方案在无侵袭性疾病生存期(IDFS)和无远处复发生存期(DRFS)方面均显示持续的长期获益。
研究结果已于2025年10月17日在德国柏林举行的欧洲肿瘤内科学会(ESMO)年会上以重磅口头报告形式发布。这些数据正在提交给全球各地的监管机构。此次公布的数据包括总生存期(OS)主要分析结果,患者中位随访时间为6.3年,其中超过75%的患者在完成为期两年的阿贝西利治疗后至少随访四年。在意向治疗(ITT)人群中,阿贝西利联合内分泌治疗较单用内分泌治疗可将死亡风险降低15.8% [7年总生存率:86.8% vs. 85.0%;风险比HR=0.842;95% CI:0.722–0.981;双侧P值=0.027]。
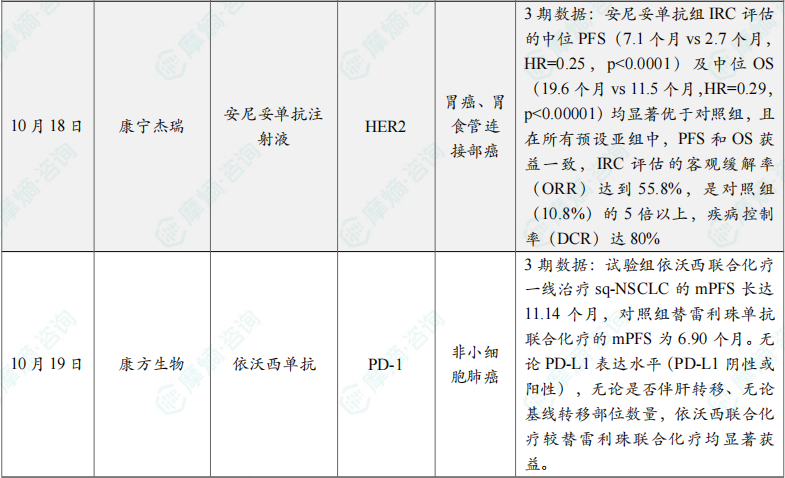
(9)康宁杰瑞公布安尼妥单抗3期临床研究最新成果
10月18日,康宁杰瑞生物制药宣布,公司自主研发、与石药集团全资附属公司上海津曼特生物科技有限公司合作开发的安尼妥单抗注射液(研发代号:KN026)联合化疗二线及以上治疗HER2阳性胃癌(包括胃-食管结合部腺癌)的Ⅲ期临床研究(研究编号:KN026-001,KC-WISE),首次期中分析结果已在2025年欧洲肿瘤内科学会(ESMO)大会上以最新突破性摘要(Late-Breaking Abstract, LBA)口头报告形式重磅公布。
KN026-001(KC-WISE)研究入组经以曲妥珠单抗为基础的治疗后出现疾病进展的HER2阳性胃癌/胃-食管结合部腺癌患者,随机接受安尼妥单抗(KN026)联合化疗(安尼妥单抗组)或安慰剂联合化疗(对照组)治疗。患者根据(ⅰ)化疗类型;(ⅱ)HER2表达水平;及(ⅲ)既往治疗线数进行分层。
临床研究结果显示:安尼妥单抗组IRC评估的中位PFS(7.1个月vs 2.7个月,HR=0.25,p<0.0001)及中位OS(19.6个月vs 11.5个月,HR=0.29,p<0.00001)均显著优于对照组,且在所有预设亚组中,PFS和OS获益一致,IRC评估的客观缓解率(ORR)达到55.8%,是对照组(10.8%)的5倍以上,疾病控制率(DCR)达80%,展现出突破性的生存获益和疗效改善。
(10)康方生物依沃西HARMONi-6 III期研究结果在ESMO公布
10月19日,康方生物自主研发的全球首创双特异性抗体新药依沃西(PD-1/VEGF双抗)联合化疗,对比替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)的注册性III期临床研究(AK112-306/HARMONi-6)重磅研究结果,由主要研究者、上海市胸科医院肿瘤科主任陆舜教授在2025年欧洲肿瘤内科学会(ESMO)年会的Presidential Symposium(主席论坛)上重磅发布。
研究结果显示,依沃西联合化疗方案对比替雷利珠联合化疗方案达到PFS主要研究终点,取得了决定性胜出强阳性结果,具有统计学显著获益和显著临床获益,依沃西联合化疗较替雷利珠联合化疗大幅延长患者无进展生存期:试验组依沃西联合化疗一线治疗sq-NSCLC的mPFS长达11.14个月,对照组替雷利珠单抗联合化疗的mPFS为6.90个月。无论PD-L1表达水平(PD-L1阴性或阳性),无论是否伴肝转移、无论基线转移部位数量,依沃西联合化疗较替雷利珠联合化疗均显著获益。依沃西组总体安全性良好,未发现新的安全性信号。
同期事件:
1. 2025年第42周10.13-10.19国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第42周10.13-10.19国内仿制药/生物类似物申报/审批数据分析
3. 2025年第42周10.13-10.19国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.10.13-2025.10.19) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论