
口服小分子GLP-1的“圣杯”已被礼来摘下:
Orforglipron,小分子、无肽链、无冷链、无注射器、无依从门槛。数据扎实、效果惊艳,距离商业化只剩一步之遥。

图源:礼来公众号
一纸相当漂亮的数据,狠狠地砸在了整个行业的神经上。“当你还在卷注射时,人家已经把注射淘汰了”。
一、时代变了
一个优异的靶点,总是能够诞生出不少的大药,GLP-1便是如此。
截至目前,全球获批上市的GLP-1药物均为多肽类产品,且绝大多数均为皮下注射给药,但我们都知道传统多肽存在很大局限性。
肽类药物,生产复杂,多肽易被胃酸降解,需特殊递送系统(如SNAC、纳米颗粒)。注射剂型保存依赖冷链、患者需要长期注射,依从性仍是制约因素。
因此全球GLP-1的统一在研方向,都在慢慢转向口服制剂。
口服GLP-1研发方向分两种:口服多肽和口服小分子。口服司美格鲁肽是目前唯一可用于口服给药的肽类GLP-1受体激动剂,虽较传统皮下注射剂已有巨大优势,但其仍有其技术方向本身的诸多局限性(服药条件苛刻)。
市场行情之下,小分子GLP-1顺势崛起,相较传统多肽GLP-1,小分子GLP-1拥有四大优势:
- 口服便利性高:小分子化合物口服给药可大幅提高患者依从性,且服药方式简单,给药前后无需严格的禁食要求等。
- 临床效果好:小分子药物更好的生物利用度和药代动力学特性,导致小分子GLP-1无论是有效性与副作用方面均有较大优势。
- 精准调节:小分子GLP-1药物的结构优化可能,导致其可针对不同的患者减重需求,进行调整。
- 低成本:当前口服多肽使用的SNAC技术,导致其用药量巨大,小分子GLP-1的制备成本较低,成本优势明显。
话说到这,已经很明显—— 相比于“口服多肽”,“口服小分子”更像是未来。
辉瑞的Danuglipron曾被寄予厚望,是行业里最早攻坚小分子口服GLP-1R激动剂的项目之一,一度引领风潮。但其每日两次服药的频率、胃肠道副作用频出、体重控制乏力…注定了它会是个“先烈”。辉瑞知耻后勇也没能翻身,最终挥泪斩马谡。
而礼来Orforglipron做到了。
Orforglipron的成功,之所以引人关注,是因为这个品对市场的影响太过于巨大。口服小分子,没有冷链、没有医疗依赖,没有饮食限制,甚至不需要门诊,只要一瓶水,随时吞下。轻松、普适、便携。这样的产品一旦进入市场,会出现什么场景?
GLP-1这条赛道将不再是“医生开、医保付、患者打”,而是“用户买、自己吃、长期用”。市场将有多大?不言而喻。
这是一种完全被革新的消费场景—— 不再是“患者”,而是“用户”;不再是“治疗”,而是“管理”;不再是“医疗”,而是“生活方式”。
而且这还不是完全。礼来真正的杀招,是对“所有弯道超车路线”的无差别封堵。
多靶点:当下进展最快的多靶点就是礼来的礼来三靶点药物Retatrutide,其二期研究终点48周的体重变化上,12mg组的体重降幅达到24.2%,十分可观。
并且其还选择与中国本土企业信达生物合作LP-1/GCGR双重激动剂玛仕度肽(IBI362),既拓展了新的双靶点药物,还能借助合作伙伴的力量对国内市场进行卡位。
联用:礼来Eloralintide联合替尔泊肽的一期试验刚登记完。
口服和小分子就更不用说,目前看来,后来者已经无法进行差异化区隔。
GLP-1的黄金时代是诺和诺德开启的,但礼来用Orforglipron把这扇门,一边焊死,一边挂上“私人产业,后人止步”的牌子。
二、国产GLP-1
截至目前,全球尚无任何一款口服小分子GLP-1产品获批上市,但作为GLP-1可预见的未来发展趋势,全球制药企业无一不在加速布局。
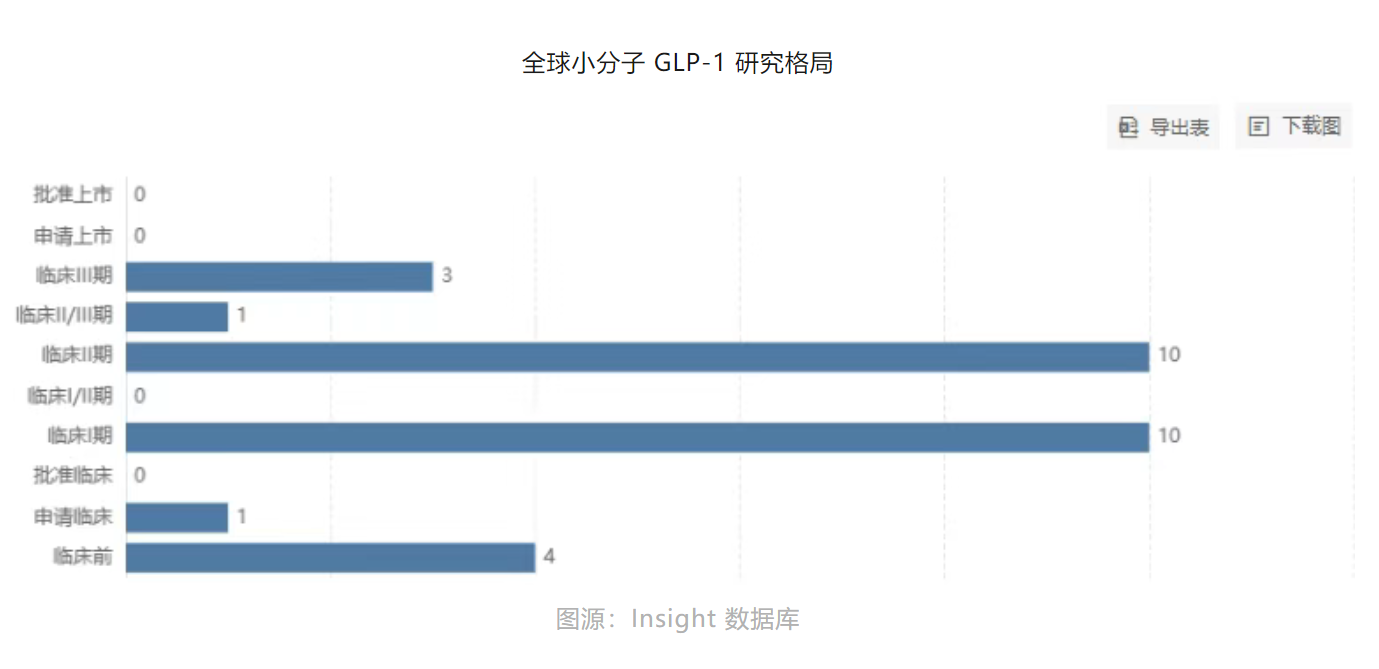
此刻看回中国。从锐格医药到诚益生物,再到闻泰医药、翰森制药、先为达等Biotech企业,据博药所述,目前已有超过30家企业正在布局小分子GLP-1产品。
大多处在临床Ⅱ期,恒瑞、闻泰已进入Ⅲ期。
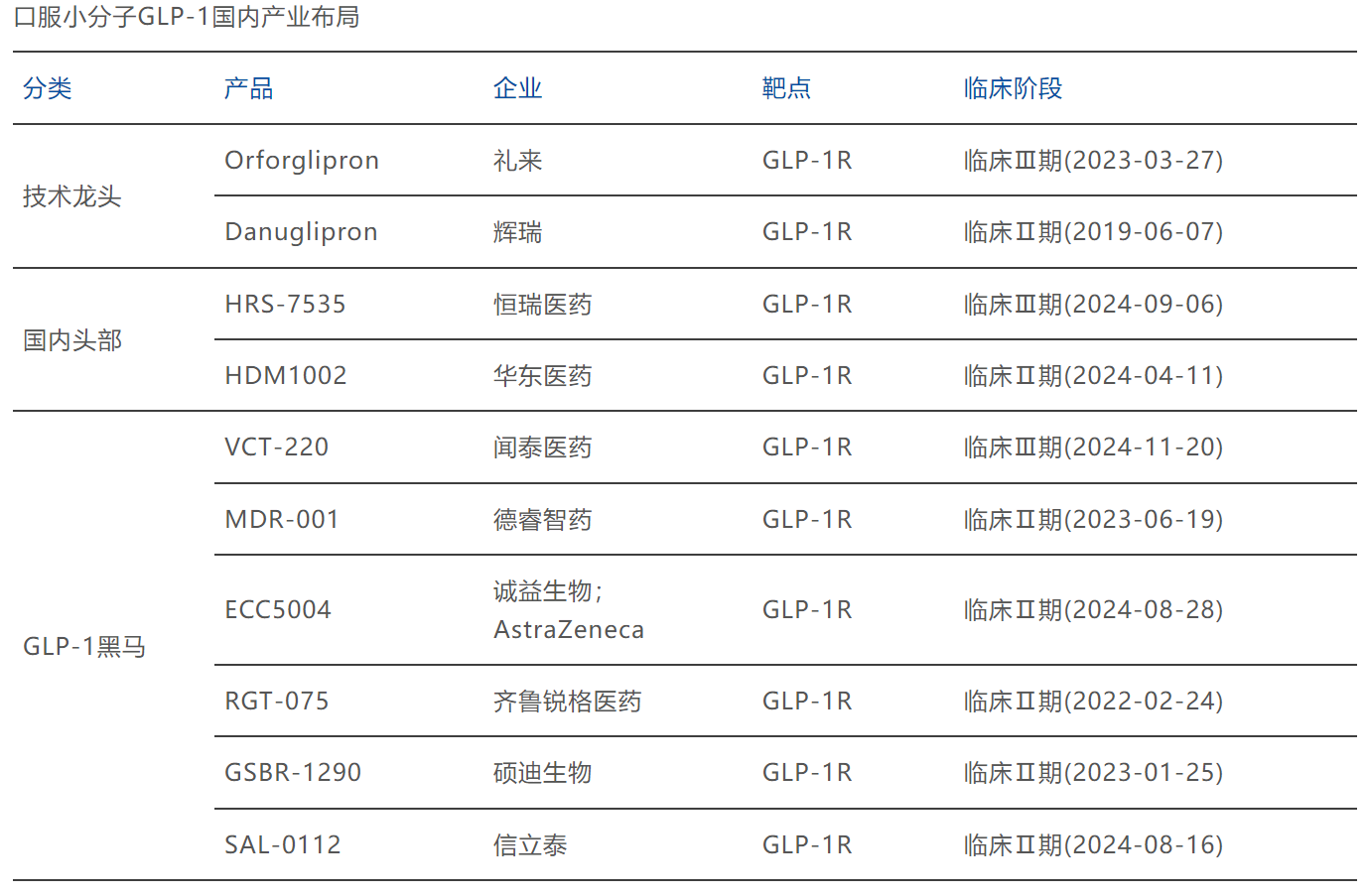
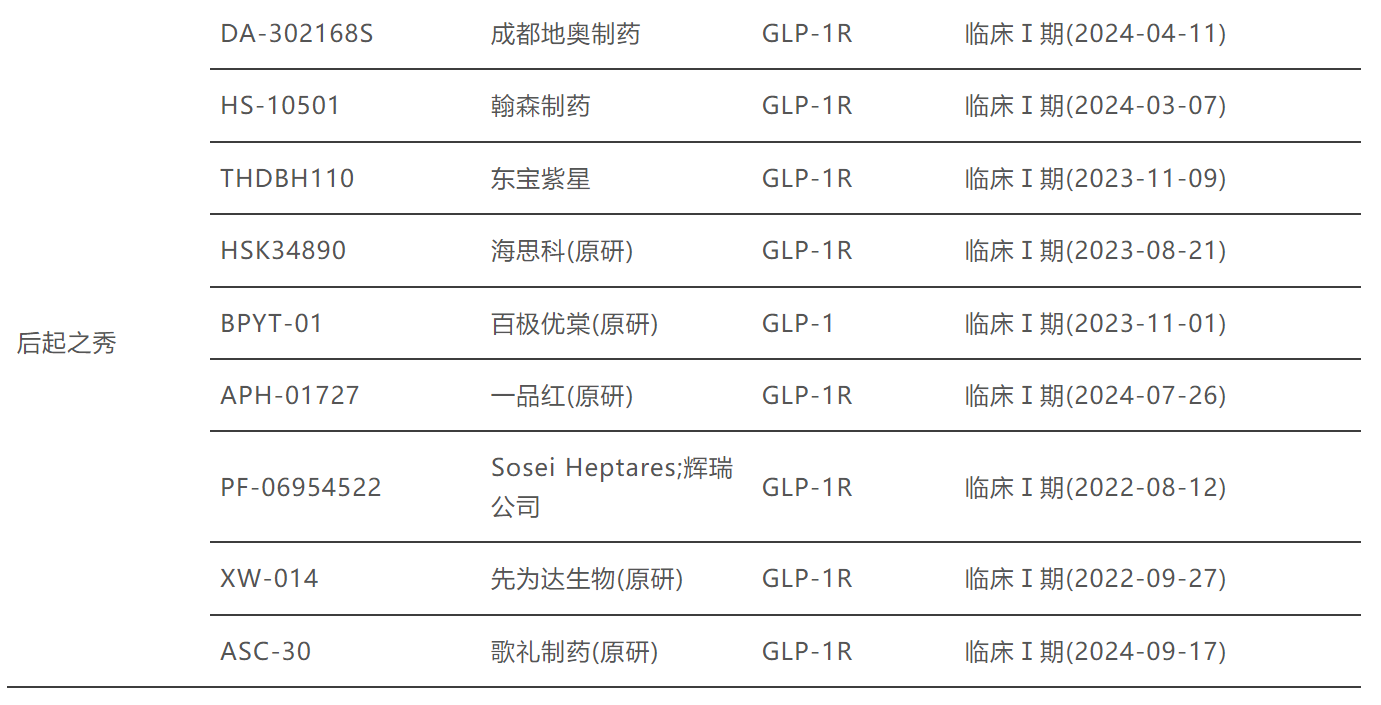
图源:博药(2025年2月)
其中不乏数据优异的黑马,未来获能与礼来Orforglipron一争:
- 德睿智药的MDR-001,其Ib/IIa期试验结果显示:受试者在服用MDR-001 12周后,受试者平均体重下降9.0%(安慰剂2.1%),安慰剂扣除后平均下降6.9%,其中87%的受试者体重下降超过5%(礼来7.9%)。
- 诚益生物的ECC5004,其在一项针对2型糖尿病患者的1期临床试验中,患者在接受为期4周的治疗期间,平均体重减轻了5.8%(礼来3.4%)。
- 锐格医药的RGT-075,其2a期试验中,12周的单剂量结果显示,经安慰剂调整后体重减轻了5%(礼来7.9%)。
- 硕迪生物的GSBR-1290,在2a阶段肥胖研究中,经安慰剂校正后8周患者体重下降幅度达6%(礼来5.7%),12周治疗组患者体重下降幅度达6.2%。
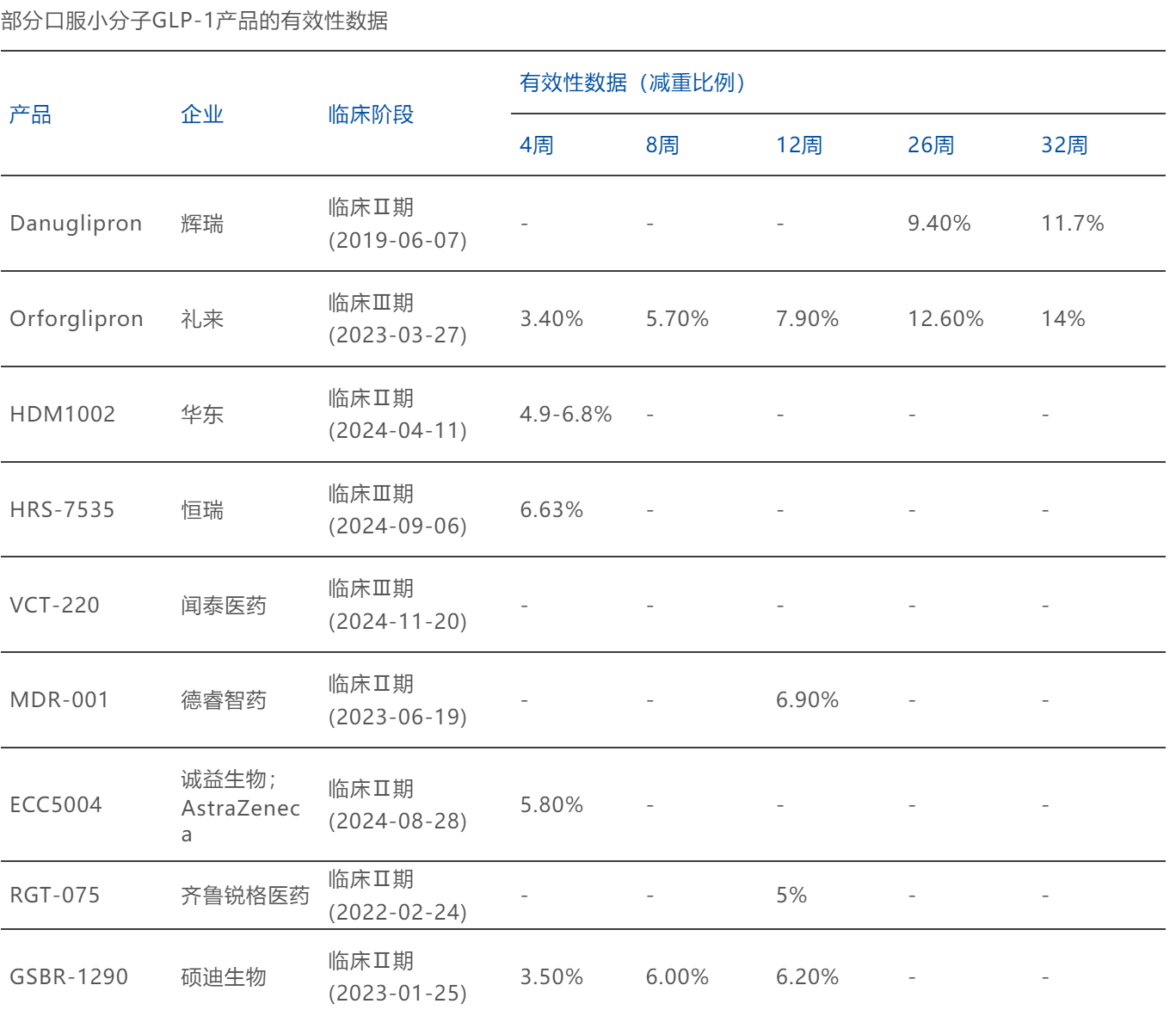
图源:博药(2025年2月)
不过小分子GLP-1研发需要超强的眼光和技术实力,国内参与的玩家并不算是很多。
国内的诸多企业还是“卷”在多肽GLP-1制剂里,尤其是卷在GLP-1多肽的生物类似药里。
据查询,目前国内自主研发的多肽GLP-1品种已有明确进度(指已申报Ⅲ期临床或上市)共有40多种,竞争的也就是这40多家企业。
然而多肽GLP-1产品的生物类似药,不过15个品种,却已有80多家企业有了明确的进度。其中最“卷”的,当属司美格鲁肽生物类似药了,已有31家企业申报临床或上市。
2026年3月司美格鲁肽核心专利到期,只剩下不到两年,红利期不长,因此谁都想抢到最前面。2025年4月,华东医药申请上市,成为继九源、丽珠、齐鲁、珠海联邦之后,第五家冲刺司美格鲁肽注射液的企业。再往后,还有深圳瀚宇、正大天晴、北京质肽、复星万邦等十余家在临床或BE试验阶段。
预计等司美格鲁肽专利到期后,仅国内的竞争企业至少三十家。
看起来“卷”得如火如荼的,但细看就会发现,这些生物类似药上市申报记录,不包含司美格鲁肽口服制剂,且暂无“减重”适应症。
一步步跟上需要花费大量时间,等国产司美格鲁肽能以“口服减重”参与竞争时,谁又会知道GLP-1会被带到哪个时代?
附:国内自主研发的多肽GLP-1品种已有明确进度项目汇总
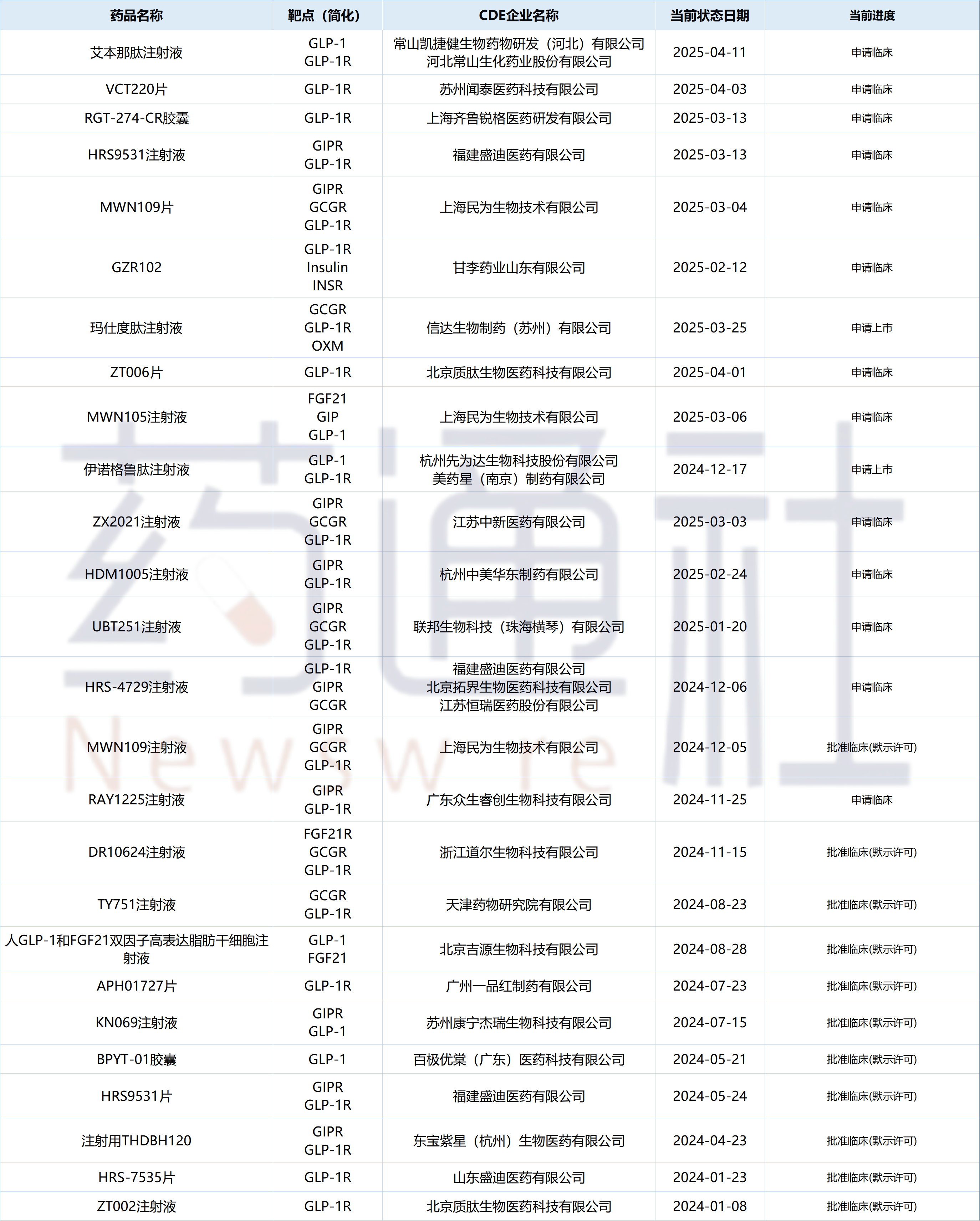
数据来源:摩熵医药数据库
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论