
在刚刚过去的11月新药领域,绿叶制药捷报频传,成绩亮眼。其中,LY03014、盐酸安舒法辛缓释片、LY03010等3款神经系统新药取得最新进展,并拿下了全球首个获批上市的地舒单抗生物类似药,冲击$58亿明星药市场。
1类镇痛新药,完成II期临床首例给药
近日,绿叶制药宣布,其LY03014(LPM-3480392)已完成II期临床首例患者给药。此次开展的II期临床试验为一项多中心、随机、双盲、安慰剂、阳性药平行对照的临床研究,旨在评估LY03014在腹部手术术后中重度疼痛患者中的初步镇痛疗效和安全性。早前,LY03014两项I期临床试验已完成。
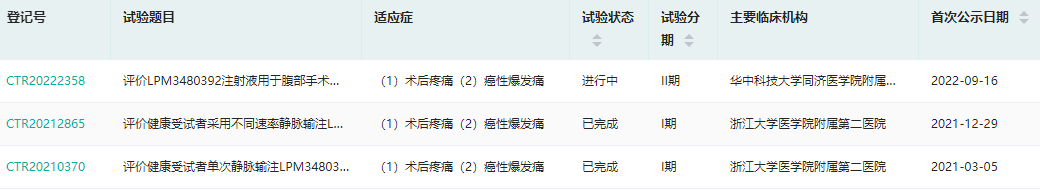
截图来源:药融云中国临床试验数据库
LY03014是一种新型的小分子Gi蛋白偏向性阿片受体(MOR)激动剂,拟用于手术后中到重度疼痛和癌性爆发痛的治疗。这是绿叶制药基于其新分子实体/新治疗实体技术平台(NCE/NTE)自主研发的1类神经系统新药,用于镇痛。
据药融云数据库统计,2021年中国麻醉及镇痛市场销售额超300亿元,2017至2021年复合增长率为9.32%;其中阿片类药物2021年院内销售额为66亿元人民币,2017至2021年复合年增长率为13.5%,增长速度超过整个麻醉镇痛领域平均增速。
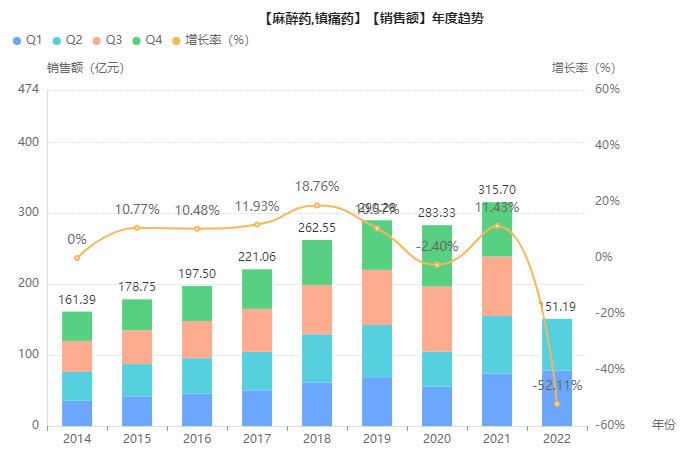
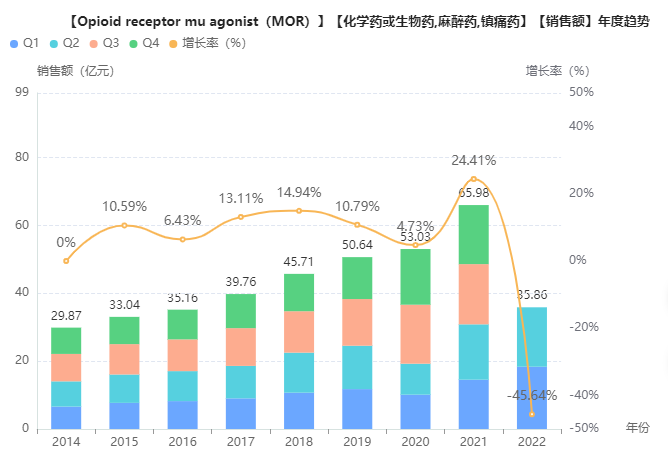
截图来源:药融云全国医院销售数据库
多款神经系统新药在研,1款获批上市
除了上述的LY03014,绿叶制药还有多款神经系统新药在研。其中,盐酸安舒法辛缓释片(LY-03005,LPM-570065)于11月3日获得NMPA批准上市,商品名:若欣林。这是我国自主研发并拥有自主知识产权的创新药,适用于抑郁症的治疗。
12月1日,恩华药业发布消息,绿叶制药与恩华药业、好心情健康产业集团及其旗下北京好心情互联网医院有限公司(以下简称好心情)签署三方战略合作协议,以推进绿叶制药近期获批上市的抗抑郁创新药若欣林(盐酸托鲁地文拉法辛缓释片)的商业化布局。通过三方各自领域专长、平台优势和商业化资源整合,若欣林在国内的商业化布局将得以加速。
据悉,绿叶制药拥有涵盖LY03005化学成份、晶体形态及制剂的专利,其中化学成份及晶体形态的专利已在中国、美国、欧洲、日本及韩国等国家和地区获得。除了中国以外,LY03005的临床试验也在美国、日本同步开展,并已分别进入新药上市申请(NDA)和I期临床试验阶段。
安舒法辛active研发详情(微信搜索"药融云小程序"进行相关更多数据查询)
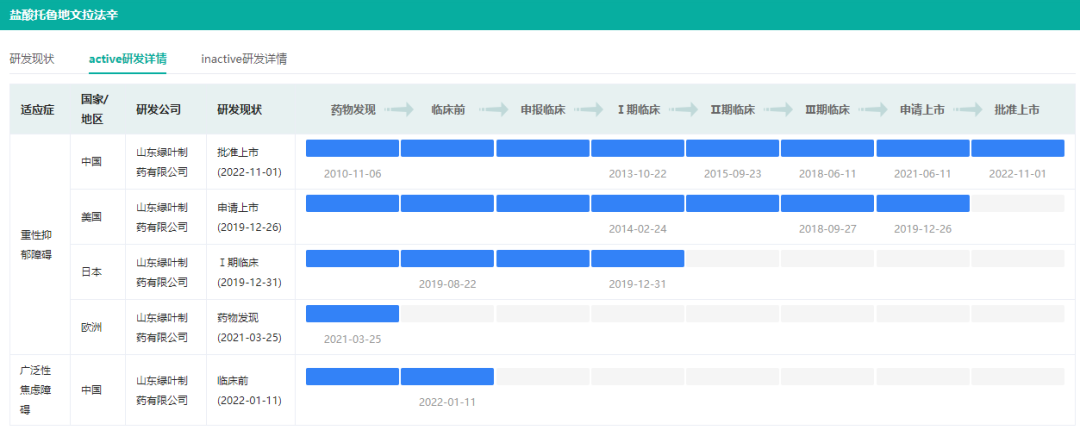
截图来源:药融云全球药物研发数据库
除此之外,绿叶制药还有数款神经系统新药正在加速推进,如适用于亨廷顿舞蹈症、迟发性运动障碍的VMAT2抑制剂LY03015,正处于临床前阶段;已完成I期临床试验的镇痛新药LY03012。
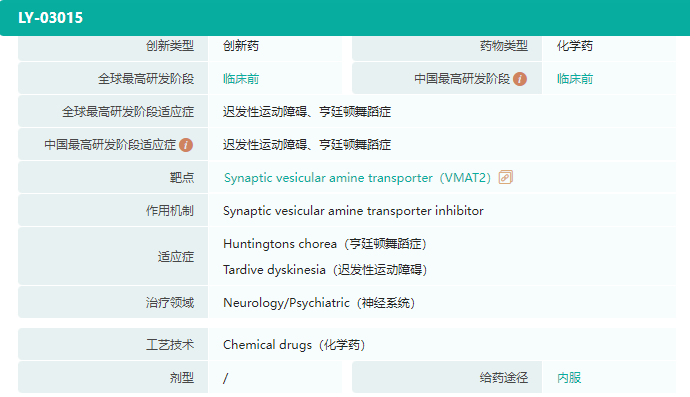
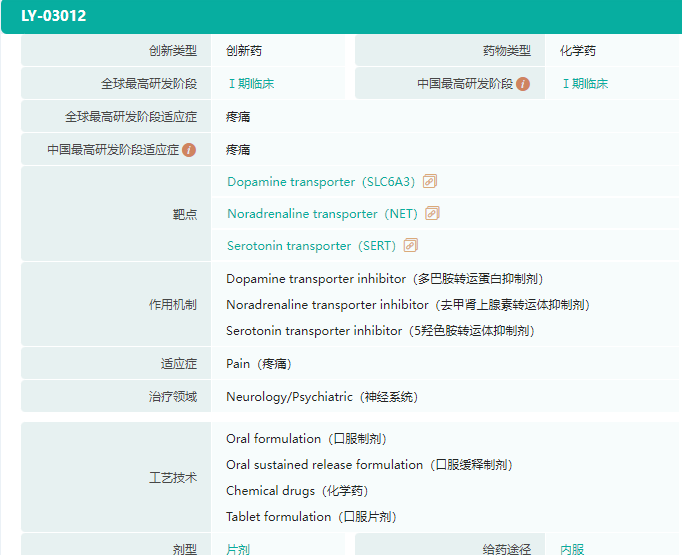
截图来源:药融云全球药物研发数据库
神经系统新药改良制剂,计划在美国申报上市
11月21日,绿叶制药发布新闻稿称,其研发的神经系统新药改良制剂——棕榈酸帕利哌酮缓释混悬注射液(LY03010)在美国开展的关键临床试验已完成数据分析,结果显示达到预期终点。基于前期和美国FDA的沟通结果,绿叶制药计划通过505(b)(2)的途径向FDA提交LY03010的上市申请。

截图来源:药融云全球药物研发数据库
据悉,LY03010是一种缓释混悬注射液,每月给药一次,以肌肉注射的方式用于精神分裂症和分裂情感性障碍的治疗。据公告内容,目前全球所有已上市用于治疗精神分裂症的长效注射剂中,以棕榈酸帕利哌酮为主要成分产品的市场销售额最高,占比达60%以上。2021年,该类型药物全球销售额为40.22亿美元;2022年前三季度,全球销售额为31.32亿美元。
斩获全球首个地舒单抗生物类似药
11月10日晚间,绿叶制药集团宣布,其控股子公司博安生物的地舒单抗注射液(博优倍®)获得上市批准,用于治疗骨折高风险的绝经后妇女的骨质疏松症;在绝经后妇女中,地舒单抗可显著降低椎体、非椎体和髋部骨折的风险。绿叶制药方面表示,博安生物也在欧洲、美国同步进行该药的国际临床和注册。
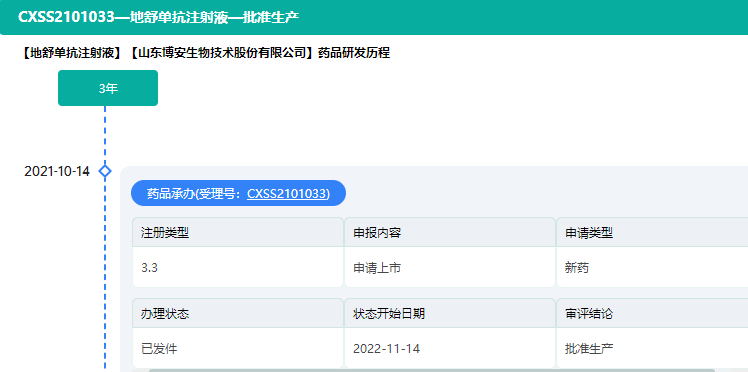
截图来源:药融云中国药品审评数据库
这既是首个国产地舒单抗注射液,又是全球首个获批上市的Prolia®生物类似药。与此同时,博优倍还是继去年5月博优诺®(贝伐珠单抗注射液)获批上市后,博安生物迎来的第二款商业化产品。据药融云全球药物研发数据库显示,2021年原研Prolia全球销售额达58亿美元;在国内,地舒单抗也正在高速增长,今年上半年院内销售额已近2亿元。
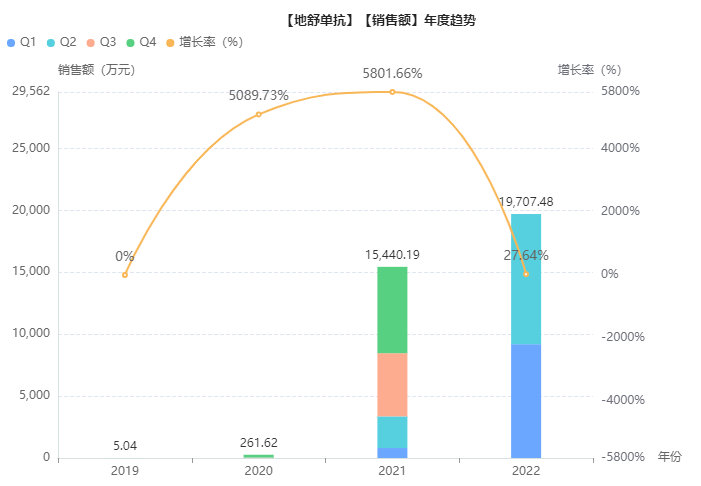
截图来源:药融云全球药物研发数据库
地舒单抗是国际上抗骨质疏松症的一线药物,获得国内外多个指南的用药推荐,临床证据显示:该药物可持续增加骨质疏松症患者的骨密度,并降低椎体、非椎体及髋部骨折的风险;可连续使用长达10年以上,且具有良好的安全性。据相关临床研究,博优倍与原研参照药的质量、安全性和有效性高度相似,无临床意义上的差异。
想要解锁更多药企药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论