
4月11日,再鼎医药与其合作伙伴argenx公司共同宣布,美国食品药品监督管理局(FDA)已正式批准艾加莫德预充式皮下注射剂型上市,用于治疗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)成人患者和慢性炎性脱髓鞘性多发性神经根神经病(CIDP)成人患者。

截图来源:argenx官网
艾加莫德(Efgartigimod)是全球首款获批的FcRn拮抗剂,通过与新生儿Fc受体(FcRn)结合,阻止FcRn介导的IgG再循环,导致IgG降解增加。
此前,艾加莫德的静脉注射剂型(IV)和皮下注射剂型(SC)已获得FDA批准上市。本次获批的是艾加莫德预充式皮下注射(PFS)剂型,该剂型使用了Halozyme公司的ENHANZE®药物递送技术,可以促进生物制剂的快速、大剂量皮下注射给药。每次注射仅需20-30秒,由患者、照护人员或医疗卫生专业人士操作。患者在接受皮下注射的指导后可自我给药。
目前,在国内艾加莫德已获批静脉输注和皮下注射2种给药方式。艾加莫德静脉输注剂型(商品名:卫伟迦)于2023年6月30日获批,用于治疗成人全身型重症肌无力(gMG)患者。
艾加莫德α注射液批文信息
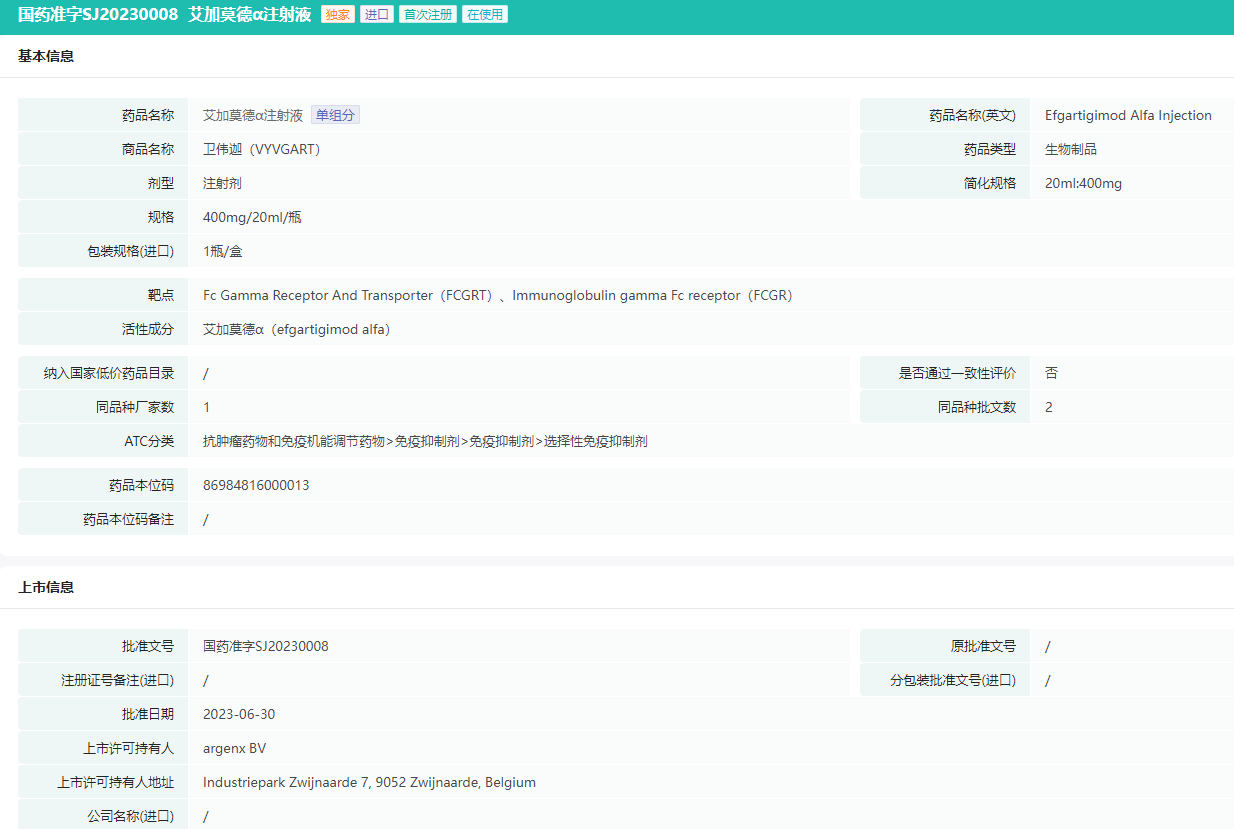
图片来源:摩熵医药中国药品批文数据库
艾加莫德皮下注射(商品名:卫力迦)于2024年11月获国家药监局批准用于CIDP治疗,是国内首个且唯一获批该适应症的靶向生物制剂。再鼎医药将于2025年在国内递交艾加莫德预充式皮下注射剂型的上市申请。
在重症肌无力治疗领域,FcRn抑制剂目前处于领先地位。其中,艾加莫德在重症肌无力患者中展现出良好的疗效,真实世界证据显示治疗方案的应答率达70%以上。其商业化潜力也得到验证,2024年艾加莫德(静脉和皮下注射)海外收入达22亿美元,同比增长84%,近三年的营收复合增长率高达134%,已成为自身免疫领域的重磅药物。在国内医院端市场,据摩熵医药数据库显示,2024年第一至第三季度,艾加莫德的销售额超过1.4亿元。























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论