1.4.1 本周全球TOP10创新药研发进展
(1)优时比罕见病新药Kygevvi获美国FDA批准上市
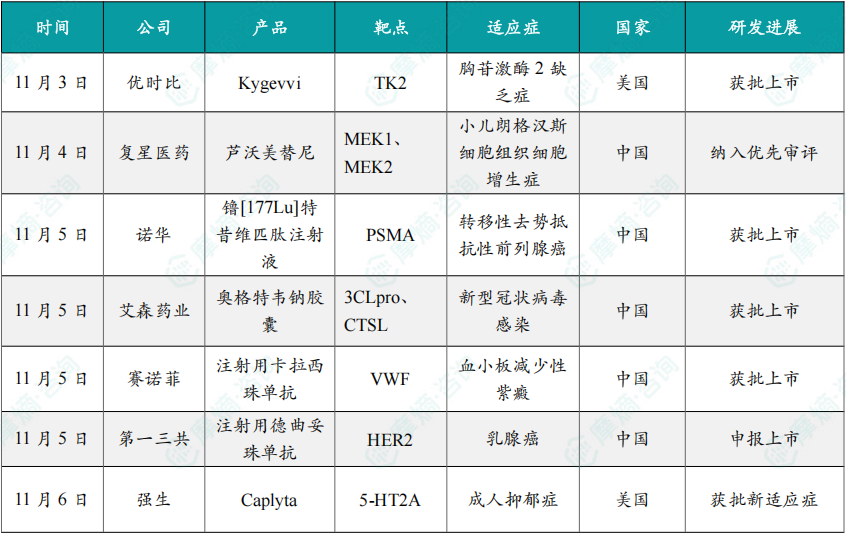
11月3日,优时比(UCB)宣布,美国FDA已批准 Kygevvi(由doxecitine与doxribtimine组成)用于治疗发病年龄在12岁及以前的胸苷激酶2缺乏症(TK2d)成人及儿科患者。
根据新闻稿,Kygevvi 是首个获批用于TK2d的治疗方案。同时,该疗法也正在接受欧洲药品管理局(EMA)的监管审评。
TK2d是一种极罕见且危及生命的遗传性线粒体疾病,以进行性、严重肌无力为主要特征。长期以来,该疾病除支持治疗外并无获批治疗药物,发病年龄在12岁及以前的患者死亡风险尤高,多数在症状出现后3年内即发生早逝。据估计,TK2d在全球的患病率约为每100万人中1.64例。
KYGEVVI 是由doxecitine和doxribtimine组成的嘧啶核苷组合药物,通过补充脱氧胞苷和脱氧胸苷,使其融入骨骼肌线粒体 DNA,修复TK2d患者受损的线粒体功能。
(2)复星医药MEK抑制剂芦沃美替尼新适应症上市申请拟纳入优先审评
11月4日,CDE网站显示,复星医药自主研发的芦沃美替尼(曾用名:复迈替尼,研发代号:FCN-159)的新适应症拟纳入优先审评,用于2岁及2岁以上朗格汉斯细胞组织细胞增生症(LCH)儿童患者。
LCH是一种以丝裂原活化蛋白激酶信号通路激活为主要分子特征的克隆性血液系统肿瘤,可累及全身各器官及系统,临床表现多样。
芦沃美替尼是复星医药自主研发的创新型小分子MEK1/2选择性抑制剂,通过阻断MAPK信号通路的异常激活,抑制肿瘤细胞增殖并诱导其凋亡。
此前,芦沃美替尼已于今年5月获批上市,用于治疗LCH和组织细胞肿瘤成人患者;2岁及2岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童及青少年患者。
(3)诺华首个放射配体疗法癌症新药在中国获批双适应症
11月5日,诺华(Novartis)公司宣布,其放射配体疗法(RLT)药物 派威妥®(镥[177Lu]特昔维匹肽注射液)的两个适应症同时获得中国国家药品监督管理局批准,分别为用于治疗既往接受过雄激素受体通路抑制剂(ARPI)后疾病进展且适合延迟化疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)成人患者和既往接受过ARPI和紫杉类化疗后疾病进展的PSMA阳性mCRPC成人患者。
放射配体疗法(RLT)是一种将放射性同位素和靶向肿瘤的特异性配体相结合的创新疗法,可以理解为一种精准锁定肿瘤细胞的“定向治疗”方案。
镥[177Lu]特昔维匹肽注射液通过静脉输液注入体内,靶向配体部分负责发现前列腺癌细胞表面的特定标记物PSMA,当随血液“巡航”至肿瘤部位时,便会精准锁定表达PSMA的肿瘤细胞。目标锁定后,镥[177Lu]能够直接辐射肿瘤病灶部位,引起肿瘤细胞DNA断裂,从而实现对肿瘤的杀伤作用。这类放射性同位素的特点是其能量相对集中,仅能在软组织中穿透约2毫米的距离。这种精确的作用范围使得放射配体疗法能在有效清除肿瘤细胞的同时,尽量减少对周围健康组织产生放射毒性。
(4)艾森药业的奥格特韦钠胶囊获批上市
11月5日,国家药监局官网显示,浙江艾森药业申报的1类创新药奥格特韦钠胶囊获附条件批准上市。该药品为口服小分子新冠病毒感染治疗药物,用于治疗轻中型新型冠状病毒感染(COVID-19)的成年患者。
奥格特韦钠是全球首个通过抑制3CL蛋白酶和组织蛋白酶L从而阻断新冠病毒入侵人体细胞并阻止新冠病毒在人体细胞中大量复制和感染的双靶点抑制剂。
2024年5月,该产品III期临床研究发表在《新英格兰医学杂志》的子刊《新英格兰医学杂志·循证(NEJM Evidence)》上。结果显示,奥格特韦钠治疗后可显著缩短症状恢复时间、快速降低病毒载量,对首阳和重复感染患者均有效、且安全副作用小。
(5)赛诺菲靶向纳米抗体卡拉西珠单抗在华获批
11月5日,赛诺菲(Sanofi)宣布其创新药物 注射用卡拉西珠单抗 正式获得中国国家药品监督管理局(NMPA)批准,用于与血浆置换和免疫抑制疗法联合治疗获得性血栓性血小板减少性紫癜(aTTP,也称为免疫介导的血栓性血小板减少性紫癜[iTTP])的成人和12岁及以上体重至少40kg的青少年患者。
这一款靶向治疗iTTP的纳米抗体药物,可实现更快速的疾病控制,减少相关死亡、恶化或重大血栓性事件,预防复发,为患者提供更为高效、安全的治疗选择。
据赛诺菲新闻稿,卡拉西珠单抗是全球首个且目前唯一获批用于aTTP治疗的新药。
(6)第一三共的德曲妥珠单抗在中国提交第8个新适应症上市申请
11月5日,CDE官网显示,第一三共的 注射用德曲妥珠单抗(DS-8201a,T-DXd,100mg/瓶)的新适应症上市申请获受理,联合帕妥珠单抗用于不可切除或转移性HER2阳性成人乳腺癌患者的一线治疗。
这是德曲妥珠单抗在中国提交的第八个适应症的上市申请,也是其在中国申报的第五个乳腺癌适应症的上市申请。
德曲妥珠单抗是一种靶向HER2的ADC,具有与曲妥珠单抗相同的氨基酸序列的人源化抗-HER2免疫球蛋白G1(IgG1)单克隆抗体(mAb),通过稳定的基于四肽的连接子与膜通透性拓扑异构酶I抑制剂DXd(依沙替康的衍生物)共价连接,可在肿瘤细胞内被选择性裂解。释放的药物载荷进入细胞核并破坏细胞内的脱氧核糖核酸(DNA),导致细胞死亡。
(7)强生小分子疗法获美国FDA批准用于治疗成人抑郁症
11月6日,强生(Johnson & Johnson)宣布其小分子疗法 Caplyta(lumateperone)再获美国FDA批准,作为与抗抑郁药联合使用的辅助治疗方案,用于治疗成人抑郁症(MDD)。
这一批准主要基于两项全球性、随机双盲、安慰剂对照的关键3期研究(Study 501和Study 502)结果。两项研究均达到主要及关键次要终点,显示在 Montgomery-Åsberg抑郁量表(MADRS)总分和临床总体印象严重度(CGI-S)评分上,相较于单用口服抗抑郁药联合安慰剂,可带来统计学显著且具有临床意义的改善。
Caplyta 是一种口服、每日一次的非典型抗精神病药。它已经获得FDA的批准用于治疗精神分裂症以及辅助治疗成人1型或2型双相情感障碍相关的精神分裂症和抑郁发作。
(8)中国首款儿童白血病CAR-T治疗产品获批上市
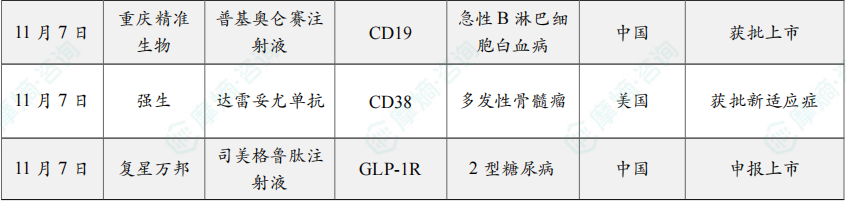
11月7日,根据NMPA官网,重庆精准生物的 普基奥仑赛注射液 通过优先审评审批程序获得附条件批准上市,用于治疗3~21岁CD19阳性的难治或复发(首次缓解12个月后复发需经挽救化疗)的急性B淋巴细胞白血病(r/r B-ALL)患者。
这是我国首款获批用于治疗儿童及青少年r/r B-ALL的CAR-T细胞治疗药物,填补了我国在该疾病领域的临床空白。
与传统CAR-T产品采用的鼠源抗人CD19 scFv不同,普基奥仑赛通过人源化抗体改造技术,并针对中国人群MHC反应性进行了优化,显著降低免疫原性和抗药抗体(Anti-drug antibody,ADA)产生的概率,有效避免了因“人抗鼠抗体反应”(HAMA反应)导致的副作用与疗效持续时间缩短等问题。
(9)强生的达雷妥尤单抗皮下注射剂在美国获批新适应症
11月7日,强生(Johnson & Johnson)公司宣布,美国FDA已批准CD38靶向单抗 Darzalex Faspro(daratumumab和hyaluronidase)皮下注射制剂作为单药,用于治疗高风险冒烟型多发性骨髓瘤(SMM)成人患者。
根据新闻稿,该疗法为首个获批用于高风险SMM患者的治疗方案。该批准主要基于3期AQUILA研究结果,研究显示,在固定疗程使用下,与积极监测相比,Darzalex Faspro皮下制剂显著降低患者进展为活动性骨髓瘤或死亡的风险达51%,展现出显著临床获益。
(10)第9款国产司美格鲁肽申报上市
11月7日,CDE官网显示,复星万邦的司美格鲁肽注射液上市申请获得受理,据推测,本次申报适应症为2型糖尿病。目前,这已是第9款申报上市的国产司美格鲁肽。
司美格鲁肽原研由诺和诺德开发。 据诺和诺德财报数据,司美格鲁肽今年前三季度销售额为1692.96亿丹麦克朗(约合254.28亿美元),占诺和诺德总营收的81.44%。
司美格鲁肽的核心专利将于2026年3月到期,目前国内已有9款国产司美格鲁肽申报上市,分别来自九源基因、丽珠集团、齐鲁制药、联邦制药、中美华东、石药集团、惠升生物、倍特药业、复星万邦,首发适应症都是2型糖尿病。
1.4.2 本周全球TOP10积极/失败临床结果
(1)罗氏CD20单抗奥妥珠单抗临床3期成功,治疗红斑狼疮
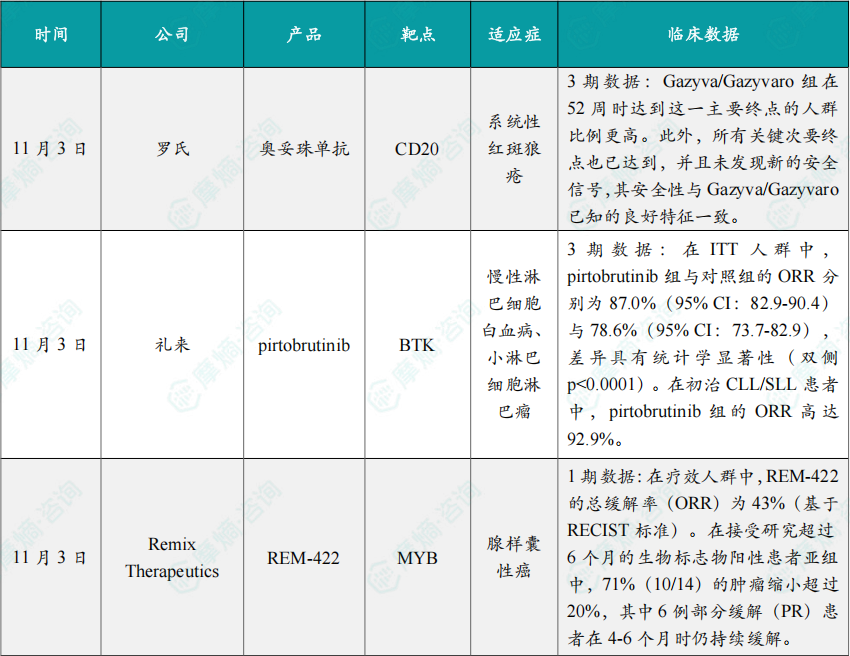
11月3日,罗氏宣布其 Gazyva®/Gazyvaro®(奥妥珠单抗,CD20单抗)在针对接受标准疗法的系统性红斑狼疮(SLE)成年患者进行的III期ALLEGORY研究达到了主要终点和所有关键次要终点,结果显示 Gazyva/Gazyvaro 能够显著减少SLE的疾病活动性。
ALLEGORY研究是一项III期、随机、双盲、安慰剂对照、多中心研究,旨在评估 Gazyva/Gazyvaro 与标准疗法相比,在接受标准疗法的SLE成人患者中的疗效和安全性。
该研究招募了约300人,受试者按1:1随机接受 Gazyva/Gazyvaro 或安慰剂治疗,持续52周,主要终点是达到SLE应答指数4(SRI-4)最低四点改善的患者百分比。
结果显示,与标准疗法相比,Gazyva/Gazyvaro 组在52周时达到这一主要终点的人群比例更高。SRI是一种评估疾病严重程度、症状和身体状况变化的工具,用于判断治疗是否有效控制了疾病活动。此外,所有关键次要终点也已达到,并且未发现新的安全信号,其安全性与 Gazyva/Gazyvaro 已知的良好特征一致。
(2)礼来公布BTK抑制剂pirtobrutinib 3期临床试验积极顶线结果
11月3日,礼来在美国血液学会(ASH)年会公布的摘要中,披露了Jaypirca(pirtobrutinib)在BRUIN CLL-314临床3期试验中的积极顶线结果。该研究评估了 pirtobrutinib 用于治疗慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)患者的疗效与安全性。
Pirtobrutinib 是一种高度选择性的非共价BTK抑制剂,此前已在既往接受过共价BTKi治疗的CLL/SLL患者中展示出明确疗效。
本次公布的数据来自 pirtobrutinib 与 ibrutinib 的首次头对头比较研究,入组对象包括初治患者及未接受过共价BTKi治疗的复发/难治(R/R)患者。
结果显示,研究达成主要终点。在ITT人群中,pirtobrutinib 组与对照组的ORR分别为87.0%(95% CI:82.9-90.4)与78.6%(95% CI:73.7-82.9),差异具有统计学显著性(双侧p<0.0001)。在初治CLL/SLL患者中,pirtobrutinib 组的ORR高达92.9%。
(3)Remix Therapeutics公司公布REM-422临床1期初步数据
11月3日,Remix Therapeutics公司宣布了其潜在“first-in-class”的MYB mRNA降解剂 REM-422 用于治疗复发或转移性腺样囊性癌的初步1期临床试验结果。
MYB是多种实体瘤和血液恶性肿瘤的致癌驱动因子。REM-422是一种强效、选择性口服小分子mRNA降解剂,通过促进mRNA转录本掺入毒性外显子,引发无义介导的mRNA降解(NMD),可减少MYB mRNA及随后的蛋白表达,从而在MYB依赖性人类肿瘤模型中产生抗肿瘤活性。该药物已获得美国FDA针对ACC和急性髓系白血病(AML)的孤儿药资格,并正在开展针对ACC和AML或高危骨髓增生异常综合征(HR-MDS)的1期临床研究。
截至2025年10月1日的数据,在疗效人群中,REM-422的总缓解率(ORR)为43%(基于RECIST标准)。在接受研究超过6个月的生物标志物阳性患者亚组中,71%(10/14)的肿瘤缩小超过20%,其中6例部分缓解(PR)患者在4-6个月时仍持续缓解。药物的总体耐受性良好,最常见的治疗相关不良事件为贫血、疲劳和鼻出血。
(4)Flare Therapeutics公布在研新药FX-909 1期临床部分数据
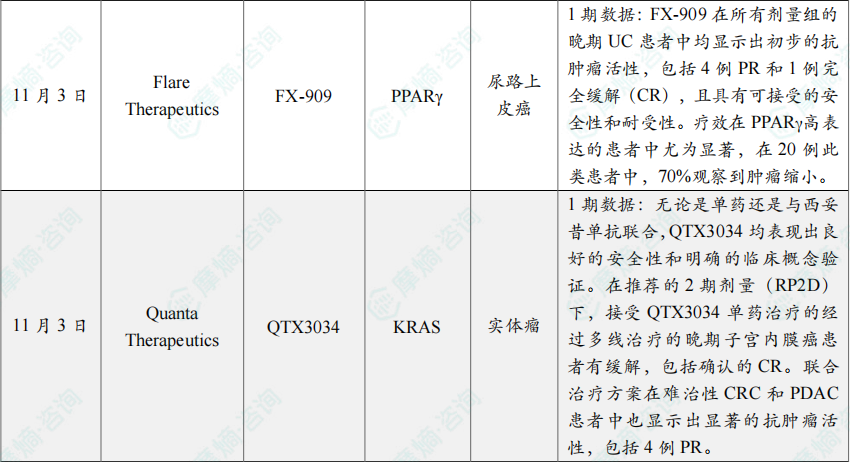
11月3日,Flare Therapeutics公司宣布了其在研新药 FX-909 用于治疗局部晚期或转移性尿路上皮癌的1期临床研究的A部分数据。
FX-909 是一种靶向PPARγ、潜在"first-in-class"的口服小分子抑制剂。该研究是一项开放标签的剂量递增试验,评估了 FX-909 在28天周期内每日口服一次的安全性、耐受性、药代动力学(PK)、药效动力学(PD)及初步临床活性,共入组了46名晚期实体瘤患者,其中36名为晚期UC患者。
截至2025年9月17日的数据,FX-909 在所有剂量组的晚期UC患者中均显示出初步的抗肿瘤活性,包括4例PR和1例完全缓解(CR),且具有可接受的安全性和耐受性。疗效在PPARγ高表达的患者中尤为显著,在20例此类患者中,70%观察到肿瘤缩小。
(5)Quanta Therapeutics公布QTX3034 1期临床数据
11月3日,Quanta Therapeutics公司宣布了其具有KRAS G12D偏好活性的多KRAS抑制剂 QTX3034 的1期临床试验数据。该疗法目前正在进行一项针对KRAS G12D突变实体瘤患者的1期临床试验。该研究同时评估了QTX3034作为单药以及与广泛使用的EGFR抑制剂西妥昔单抗联合用药的安全性、耐受性及初步疗效,入组患者包括晚期结直肠癌(CRC)、胰腺导管腺癌(PDAC)和子宫内膜癌患者。
截至2025年9月23日的数据,无论是单药还是与西妥昔单抗联合,QTX3034 均表现出良好的安全性和明确的临床概念验证。在推荐的2期剂量(RP2D)下,接受QTX3034单药治疗的经过多线治疗的晚期子宫内膜癌患者有缓解,包括确认的CR。联合治疗方案在难治性CRC和PDAC患者中也显示出显著的抗肿瘤活性,包括4例PR。安全性方面,药物耐受性良好,不良事件多为低级别且可控,未观察到剂量限制性毒性(DLT)或≥3级的治疗相关不良事件。药代动力学数据显示药物口服吸收良好,且分子层面的强效反应(KRAS G12D ctDNA减少>90%)与抗肿瘤活性密切相关。这些结果支持当前正在进行的剂量扩展研究,并为后续与标准化疗方案的联合应用提供了依据。
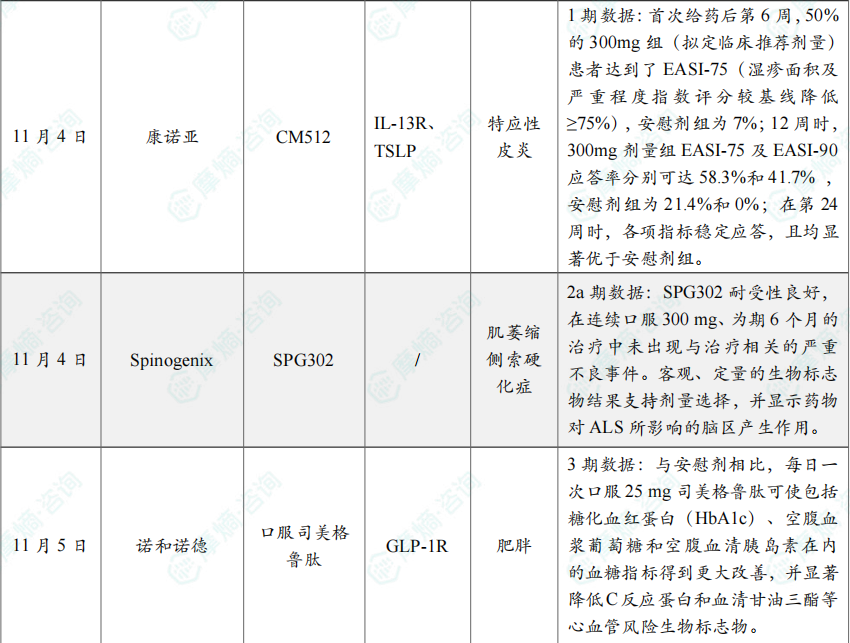
(6)康诺亚特应性皮炎长效新药1期临床结果公布
11月4日,康诺亚宣布,公司自主研发的长效TSLPxIL-13双阻断剂 CM512 治疗成人中重度特应性皮炎的1期临床研究达成全部研究终点。
研究显示,CM512 在治疗中重度特应性皮炎患者中展现出快速疾病控制能力,具有深度缓解及持久稳定的疗效特征,半衰期长达70天,安全性良好。CM512 在健康受试者和中重度AD患者中PK特征相似,体内暴露量随着剂量的增加而成比例增加。半衰期长达70天,支持临床评估更长给药间隔。首次给药后第6周,50%的300mg组(拟定临床推荐剂量)患者达到了EASI-75(湿疹面积及严重程度指数评分较基线降低≥75%),安慰剂组为7%;12周时,300mg剂量组EASI-75及EASI-90应答率分别可达58.3%和41.7% ,安慰剂组为21.4%和0%;在第24周时,各项指标稳定应答,且均显著优于安慰剂组。
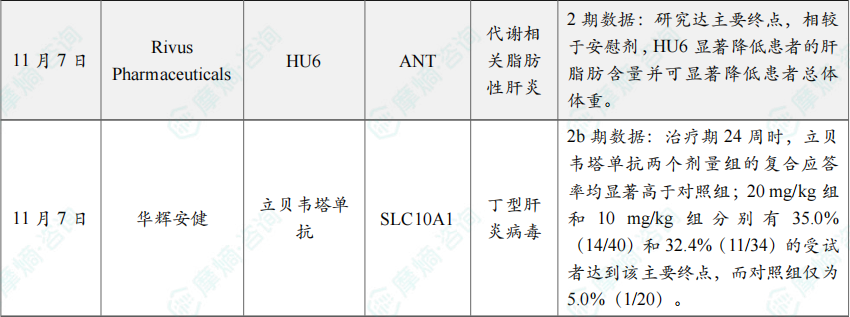
(7)Spinogenix公布SPG302 2a期临床试验积极数据
11月4日,Spinogenix公布了其2a期临床试验的初步积极顶线结果。该试验评估在研疗法 SPG302 用于肌萎缩侧索硬化症(ALS)患者的治疗效果。
根据新闻稿,SPG302 是首款突触再生药物,可减缓ALS患者的疾病进展。这项2a期随机、双盲、安慰剂对照临床试验共纳入23名ALS患者,试验结果的初步分析显示:SPG302 耐受性良好,在连续口服300 mg、为期6个月的治疗中未出现与治疗相关的严重不良事件。客观、定量的生物标志物结果支持剂量选择,并显示药物对ALS所影响的脑区产生作用。脑电图(EEG)活动显示ALS相关脑活动模式出现改善,与功能衰退速度的减缓趋势相一致。在治疗结束时,82%的SPG302组患者表现为功能下降速度稳定或改善(基于ALS功能评分量表修订版ALSFRS-R评估)。与PRO-ACT数据库的历史对照相比,这些患者在6个月随访中平均功能下降速度降低约76%。
(8)诺和诺德口服司美格鲁肽3期试验最新分析积极结果公布
11月5日,诺和诺德(Novo Nordisk)公布了OASIS 4临床3期试验的最新数据。事后分析结果显示,在研口服司美格鲁肽(semaglutide)25 mg在多种体重减轻幅度类别中,均与血糖控制及心血管(CV)风险因素的显著改善相关。与安慰剂相比,每日一次口服25 mg司美格鲁肽可使包括糖化血红蛋白(HbA1c)、空腹血浆葡萄糖和空腹血清胰岛素在内的血糖指标得到更大改善,并显著降低C反应蛋白和血清甘油三酯等心血管风险生物标志物。
此外,另两项分析也表明,该药物在不同绝经状态的肥胖女性中均呈现一致的减重效果,同时患者的身体功能状况也有所提升。
(9)Rivus公布在研疗法HU6临床2期数据
11月7日,Rivus Pharmaceuticals公布了其在研疗法 HU6 用于治疗代谢功能障碍相关性脂肪性肝炎(MASH)的2期M-ACCEL试验最新临床数据。
分析显示,研究达主要终点,相较于安慰剂,HU6 显著降低患者的肝脂肪含量并可显著降低患者总体体重。值得一提的是,患者的体重减少完全来自脂肪减少,瘦体重和骨骼肌质量未受影响。
基于此次积极结果,Rivus计划进一步启动2期AMPLIFY试验,以确认在未来进入后期临床阶段前的HU6最佳剂量。
截至目前,已有约450名患者接受过HU6治疗,为后续临床推进奠定了基础。HU6 是一种可控代谢加速器(CMA),通过有限度激活线粒体解偶联这一自然代谢过程发挥作用。
(10)华辉安健公布抗丁肝新药立贝韦塔单抗2b期临床研究最新数据
11月7日,华辉安健宣布,公司将在第76届美国肝病研究协会(AASLD)2025年会上以最新突破摘要(Late-Breaking Abstract)口头报告(Oral Presentation)的形式,公布自主研发的立贝韦塔单抗(HH-003)在治疗慢性丁型肝炎病毒(HDV)感染的关键注册临床2b期研究(HH003-204)48周的临床数据。
立贝韦塔单抗是华辉安健开发的乙肝/丁肝病毒PreS1单抗药物。其主要作用机制为通过特异性结合乙肝/丁肝病毒表面的PreS1区域,阻断乙肝/丁肝病毒和其受体NTCP的结合从而阻止病毒感染或再感染肝细胞。
试验结果表明,立贝韦塔单抗治疗慢性HDV感染者在复合终点应答率、病毒学抑制、ALT复常及肝脏硬度改善方面均显示出优于对照组的统计学显著且具有临床意义的疗效;立贝韦塔单抗两个治疗组在48周治疗期内均表现出良好的耐受性和优异的安全性。治疗期24周时,立贝韦塔单抗两个剂量组的复合应答率均显著高于对照组;20 mg/kg组和10 mg/kg组分别有35.0%(14/40)和32.4%(11/34)的受试者达到该主要终点,而对照组仅为5.0%(1/20)。治疗48周时,立贝韦塔单抗两个剂量组的复合应答率进一步增加,20 mg/kg组和10 mg/kg组的复合应答率分别提升至42.5%和44.1%,而对照组仍维持在5.0%。
同期事件:
1. 2025年第45周11.03-11.09国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第45周11.03-11.09国内仿制药/生物类似物申报/审批数据分析
3. 2025年第45周11.03-11.09国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.11.03-2025.11.09) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第35周08.26-09.01全球创新药研发概览
2. 2024年第36周09.02-09.08全球创新药研发概览
3. 2024年第37周09.09-09.15全球创新药研发概览
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论