
文 | 不二
封面 | Pixabay
2021.09.17-2021.09.23期间药审要点:
- 本周药审112个品种获受理,化药76个;
- 恒瑞医药、百济神州......9款1类新药亮相申报临床;
- 新增9个按仿制药质量和疗效一致性评价品种申报的受理号;
- 5个品种通过(含视同通过)一致性评价,辽宁海思科制药「注射用盐酸头孢替安」首家过评;
- 恒瑞医药厉害了,5款新药临床申请获批,SHR-1701迎新适应症
海思科「注射用盐酸头孢替安」首家过评
2021年9月17日至9月23日期间,共有5个品种通过(含视同通过)一致性评价。有辽宁海思科制药「注射用盐酸头孢替安」首仿获批上市。具体信息如下。另邦顺制药、施贝康等有6款新药将上市。

数据来源:药融云数据库
海思科的注射用盐酸头孢替安通过一致性评价,成为该产品首家过评企业。注射用盐酸头孢替安是中国公立医疗机构终端头孢类注射剂的TOP16产品。盐酸头孢替安属于第二代头孢菌素,是一种广谱的抗菌药物,对革兰氏阳性球菌中敏感的葡萄球菌、链球菌以及大肠埃希菌、肺炎克雷伯菌、流感嗜血杆菌等革兰氏阴性杆菌均有较好的抗菌活性。
信达生物达伯舒®迎新适应症......
9月17日至9月23日期间共112个(按品种计,下同)药品获CDE承办,包括化药76个,生物制品16个,中药20个。近期CDE承办的共有1款新药申请上市,15个品种申报临床,其中包括13款国产新药,另有8个品种提交一致性评价。
新药申请上市承办情况

数据来源:药融云数据库
信迪利单抗(商品名为达伯舒®)是信达生物和礼来合作研发的创新PD-1抑制剂药物。此次上市申请为新适应症。根据信达之前的新闻稿,推测本次的适应症是信迪利单抗联合化疗一线治疗食管鳞癌。
图片来源:企业官网
目前,信迪利单抗已在中国获批四项适应症,分别是:
- 用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤;
- 联合培美曲塞和铂类化疗用于EGFR或ALK阴性的晚期非鳞状NSCLC的一线治疗;
- 联合吉西他滨和铂类化疗适用于不可手术切除的局部晚期或转移性鳞状NSCLC的一线治疗;
- 联合达攸同®(贝伐珠单抗注射液)用于肝细胞癌的一线治疗。
9款1类新药申请临床获受理,恒瑞医药、璧辰医药、百济神州......
新药申请临床承办情况
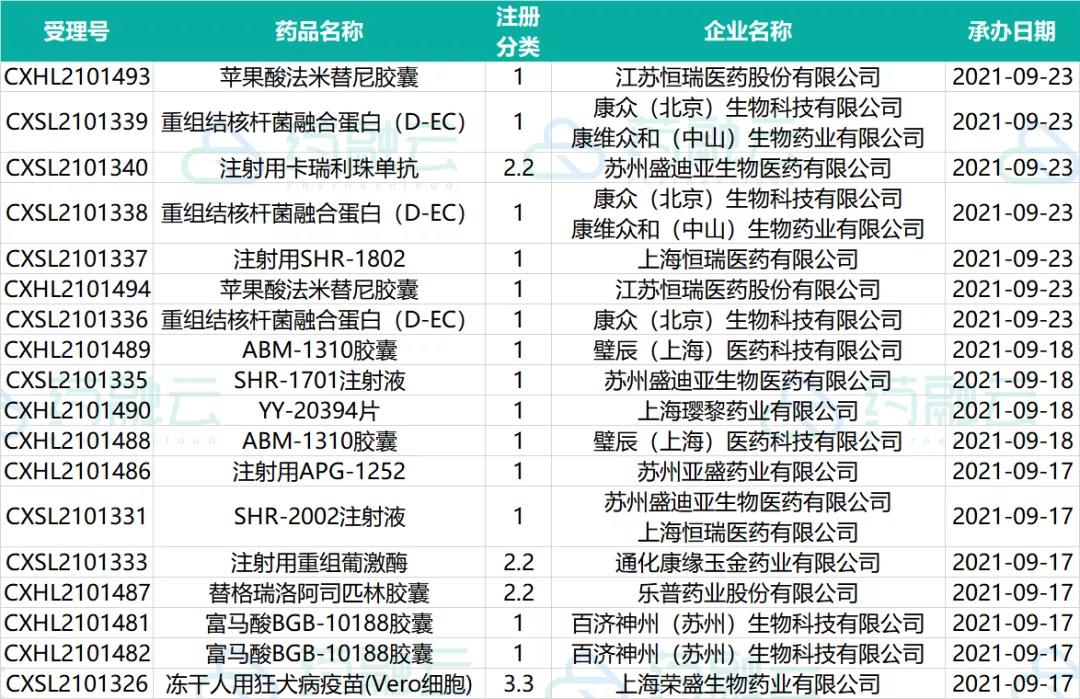
数据来源:药融云数据库
ABM-1310是璧辰医药自主研发的新一代口服BRAF抑制剂,具有理想的血脑屏障渗透率。在动物实验中,ABM-1310的大脑自由浓度达到100%。同时在相关的脑转移和脑原位动物模型中,ABM-1310显著优于维罗非尼,同等剂量的ABM-1310将中位生存期延长了一倍。该候选药物于2019年11月获得FDA临床试验许可,2020年已经在美国开展临床I期试验。
恒瑞医药SHR-1701新适应症临床获批,联合伊立替康脂质体用于经PD-1/PD-L1单抗联合含铂化疗一线治疗失败的局部晚期或转移性食管鳞癌患者。伊立替康脂质体是恒瑞医药研发的改良型创新药,拓扑异构酶1的抑制剂被包载在一个磷脂双分子层囊泡或脂质体中。脂质体作为一类新型制剂的药物载体,具有保护内酯环的活性结构作用、被动靶向性和缓慢释放药物特点。
百济神州肿瘤1类新药富马酸BGB-10188胶囊申请临床,BGB-10188,是一种高选择性PI3Kδ抑制剂,它具有更高的安全性和卓越的体内抗肿瘤活性。
延伸阅读
根据百济神州在2020年美国癌症研究学会(AACR)上发布的摘要,BGB-10188在生化、细胞和人类全血测定表现出对PI3Kδ的有效抑制,IC50范围为1.7-16 nM。它还在小鼠药效学 (PD) 研究中以低至10mg/kg 的剂量显示出持久和强大的靶标抑制活性。BGB-10188在血浆中的生物半衰期 (t1/2) 在大鼠和狗中分别为12.6小时和10.4小时。
BGB-10188作为单药在不同类型的B细胞淋巴瘤异种移植模型中都显示出显着的抗肿瘤作用,与PD-1和PD-L1抗体联用时,抗肿瘤效果还能进一步提升。
一致性评价申请承办情况
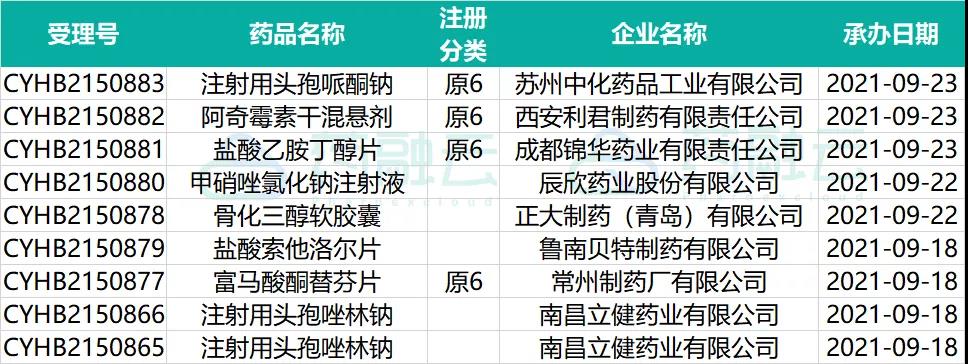
数据来源:药融云数据库
—END—
本文为原创稿件,未经授权请勿转载。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论