
以史为鉴,开创未来!
医药创新的探路者们,在药物研发的道路,失败的经验是非常宝贵的,对于后来者的研发指引非常有价值。
基于药融云数据库以及公开信息统计,2023年1月有5项临床试验失败的经典案例,涉及强生、诺华、默沙东等大药企,也有针对糖尿病领域的biotech。
一、诺华:镰状细胞药物Adakveo一项3期临床试验失败
1月27日,endpts媒体报道,诺华的镰状细胞药物Crizanlizumab(Adakveo),未能通过正在进行的3期研究,以临床试验失败告终。诺华公布了正在进行的STAND III期研究的早期数据,称Crizanlizumab(Adakveo)在两种不同剂量水平下与安慰剂相比,在随机进入试验后第一年导致医疗访问的血管阻塞危机的年化率上没有统计学上的显著差异。
Crizanlizumab的化学结构
图片来源:药融云数据库
Crizanlizumab于2019年11月获得FDA批准,以降低血管阻塞危机的频率。该药物于2016年以6.65亿美元的价格从Selexys收购。当时被誉为“潜在的10亿美元炸弹”。据诺华财报,2021年Adakveo销售额为1.64亿美元,同比增长56%。2022年前三季度营收1.43亿美元,同比增长18%。

图片来源:药融云数据库
Adakveo价格为每瓶2592美元,适用于16岁及以上的患者。据了解由于处方是根据体重开的,大多数患者每月服用三到四瓶,每月花费在7700-1万美元左右。
镰状细胞病近年来吸引了越来越多的关注。据药融云数据,辉瑞的前合作伙伴GlycoMimetics,该公司在2019年也有一种候选药物的III期临床试验失败,未能达到主要和次要终点。不过在去年12月,Editas Medicine报道了两名镰状细胞病患者的一些早期数据,指出在接受细胞疗法候选治疗后的最初几个月随访中,两名患者都没有出现血管闭塞事件。
二、默沙东:终止K药一项前列腺癌III期研究
1月25日,默沙东宣布K药(帕博利珠单抗)的III期KEYNOTE-991研究在中期分析中未达到改善总生存期(OS)和影像学无进展生存期(rPFS)的主要终点,因此决定终止该研究。
帕博利珠单抗中国医院销售情况
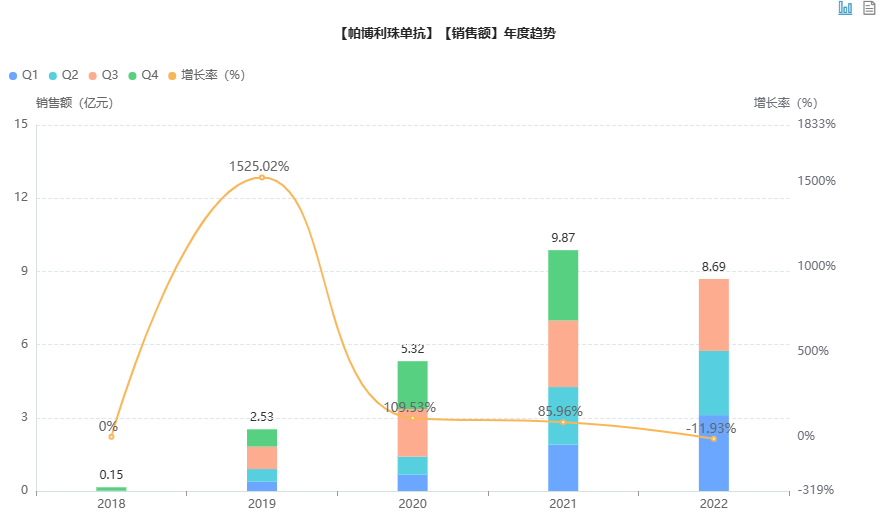
图片来源:药融云全国医院销售数据库
KEYNOTE-991是一项研究PD-1抑制剂帕博利珠单抗+恩扎卢胺(Enzalutamide)+雄激素剥夺治疗(ADT)联合治疗转移性激素敏感性前列腺癌(mHSPC)患者的III期临床试验,共招募了1251位患者。
根据独立数据监控委员会的建议,MSD将停止该试验。因为KEYNOTE-991临床试验的中期分析发现,与安慰剂+恩扎卢胺+ADT相比,帕博利珠单抗+恩扎卢胺+ADT联合治疗并没有展现出总生存期(OS)或影像学无进展生存期(rPFS)的改善,这是该试验的双重主要终点。
在安全性方面,帕博利珠单抗在该试验中的安全性与之前研究中观察到的安全性一致,未发现新的安全信号。然而,与对照组相比,该联合疗法3-5级不良事件和严重不良事件的发生率更高。
这是K药在不到一年的时间内第三次在前列腺癌领域受挫,但在胆道癌领域默沙东宣布了胜利。
- 2022年3月,帕博利珠单抗联合奥拉帕利(Lynparza)治疗转移性去势抵抗性前列腺癌(mCRPC)的III期KEYLYNK-010临床试验,因未达到主要终点且3-5级不良事件发生风险提高而被默沙东终止。
- 2022年8月,默沙东宣布帕博利珠单抗联合多西他赛(Docetaxel)治疗转移性去势抵抗性前列腺癌的III期KEYNOTE-921临床试验未达OS和rPFS的双重主要终点。
三、杨森:HIV疫苗3期临床试验失败
2023年1月18日,强生旗下杨森制药(Janssen Pharmaceuticals)公布了其在研HIV-1疫苗Ad26.Mos4.HIV的III期Mosaico研究的独立定期数据审查结果。经独立数据和安全监测委员会(DSMB)评估,与安慰剂相比,Ad26.Mos4.HIV在预防HIV-1感染方面无效。此外,DSMB表示该研究也无望达到其主要终点。根据DSMB的意见,杨森制药将终止Mosaico研究并进一步分析现有数据。

图片来源:药融云全球临床试验数据库
强生的HIV疫苗全称为Ad26.Mos4.HIV,以腺病毒为载体,是一种4价疫苗,包括Env、Pol、Gag、Env相关蛋白四种抗原。Mosaico三期临床从2019年开始启动,经历3年多时间,终究还是以临床试验失败告终。
此前,强生曾在2021年8月宣布Ad26.Mos4.HIV在IIb期Imbokodo中的临床试验失败。结果显示,Ad26.Mos4.HIV联用Clade C gp140方案在有HIV-1感染风险的撒哈拉以南非洲成年女性中无HIV-1感染预防效果。
Mosaico研究是一项多中心、随机、双盲、安慰剂对照的III期临床试验,共纳入3900例顺性别(Cis-gender)男性和跨性别者(Transgender)受试者,旨在评估Ad26.Mos4.HIV联用Clade C/Mosaic gp140方案预防HIV-1感染的有效性和安全性。患者将在一年内接种4剂Ad26.Mos4.HIV,并在接种最后2剂时额外接种Clade C/Mosaic gp140。研究的主要终点为首次接种疫苗第7个月后至第X(24-30)个月的HIV-1感染率。

1月24日,强生公布2022年业绩: 全年实现总收入949.43亿美元,同比增长1.3%;其中制药业务收入525.63亿美元(+1.7%),医疗器械业务收入274.27亿美元(+1.4%),消费者保健业务收入149.53亿美元(+0.5%)。全年研发投入146.03亿美元,同比下降0.8%,与2021年基本持平。其中比较耀眼的是乌司奴单抗营收97亿美元,增长6.5%;达雷妥尤单抗营收79.77亿美元,增长32.4%。
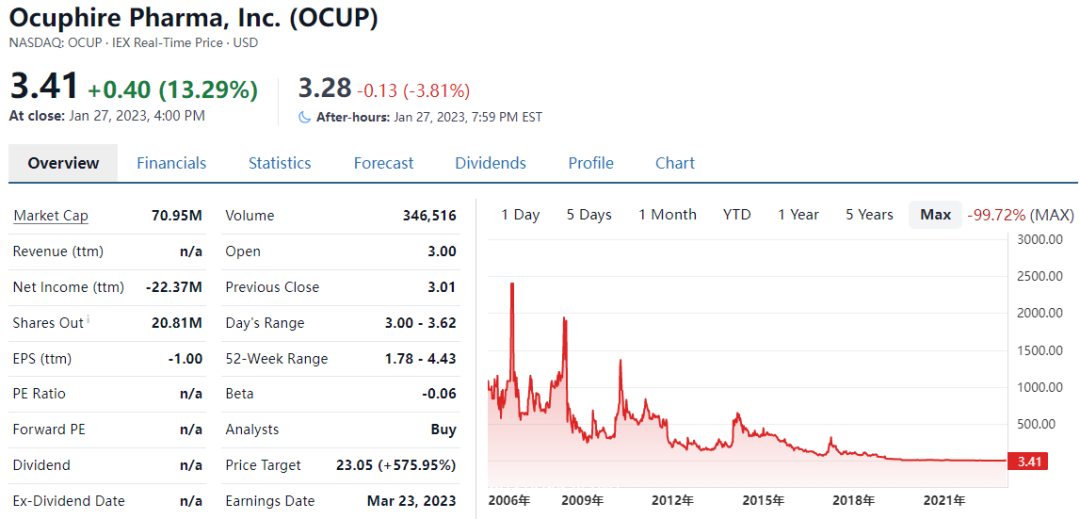
四、Ocuphire:糖尿病视网膜病变的口服药临床2期临床试验失败
1月25日,Ocuphire Pharma, Inc.(纳斯达克股票代码:OCUP),一家临床阶段的眼科生物制药公司,专注于开发和商业化治疗眼部疾病的疗法,公布了其ZETA-1 2期试验评估口服APX3330治疗糖尿病性视网膜病变(DR )的主要疗效和安全性结果。该药物在糖尿病视网膜病变ZETA-1试验中未能达到主要终点,未能帮助足够多的患者在第24周时实现糖尿病视网膜病变严重程度量表(DRSS)的两步改善,宣布临床试验失败。

但该药物APX3330在一项次要终点上确实达到了统计学显著性,公司计划将其作为三期试验的主要终点。Ocuphire表示,他们正在寻求与FDA会面以确认这一点。
受到此药物临床试验失败消息的影响,当日股价大跌20%,自上市以来市值蒸发99%,目前仅剩0.7亿美元。
据药融云数据库,2020年2月8日海昶生物从Ocuphire获得RX-0047全球独家开发及商业化权益。

截图来源:药融云全球药物研发数据库
糖尿病性视网膜病变可导致视力丧失,是全世界日益关注的问题。Ocuphire Pharma的APX3330作为第一种口服药物治疗糖尿病性视网膜病变的希望仍然存在。不过截止到2022年Q3公司仅有现金及等价1300多万美元,前三季度研发支出1076万美元。但在2022年11月7日,Ocuphire Pharma和FamyGen Life Sciences就Nyxol滴眼液的开发和商业化达成全球许可协议,获3500万美元预付款,短期可以有效缓解资金压力。
五、Oramed:口服胰岛素胶囊3期临床试验失败,终止临床开发
2023年1月11日Oramed Pharmaceuticals Inc.(纳斯达克/TASE: ORMP)是一家专注于口服给药平台开发的临床阶段制药公司,宣布其口服胰岛素胶囊ORMD-0801治疗2型糖尿病(T2DM)的III期临床试验(ORA-D-013-1研究)未达到主要终点和次要终点,以临床试验失败告终。与安慰剂相比,ORMD-0801未能显著改善患者的血糖控制,没有严重的药物相关不良事件。ORA-D-013-1纳入了710例T2D患者和两种或三种口服降糖药的血糖控制不足的患者。基于此结果,Oramed表示将终止ORMD-0801针对T2DM的临床开发工作。

受到此药物临床试验失败消息的影响,Oramed股价大跌超过70%,目前市值仅0.75亿美元。
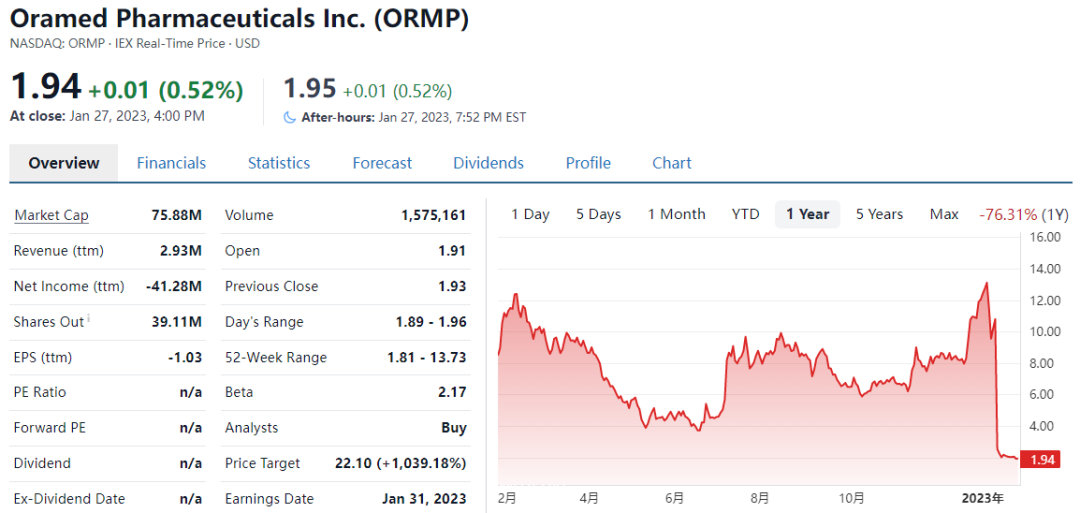
Oramed首席执行官Nadav Kidron表示:“先前研究均取得了积极的结果,但是这项III期临床试验却失败了,这是非常令人失望的。在获得该研究的完整数据后,我们将公布相关的分析结果以及未来的研究计划。我们感谢所有参与试验的患者、家属和医疗保健专业人员。”

Nadav Kidron, Oramed CEO
Oramed一直在开发一种更简单的方式来输送胰岛素,而不是通过针或泵。Oramed公司表示,他们的胶囊可以保护胰岛素不受肠道酸碱度和酶的影响,并帮助胰岛素通过肠壁被吸收。另一家生物技术公司i2o Therapeutics与强生(J&J)和赛诺菲(Sanofi)合作,同样也在研究一种口服给药方法,可以保护治疗不受腐蚀性肠道环境的影响。它的适应症之一是II型糖尿病。
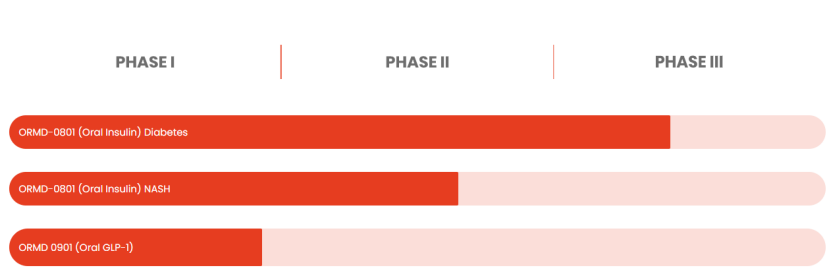
图:Oramed Pharmaceuticals研发管线
据Oramed网站介绍,该公司还在测试口服胰岛素治疗非酒精性脂肪性肝炎(NASH),并在早期研究中使用口服GLP-1类似物。Oramed于11月完成了口服胰岛素治疗NASH的II期试验,但该研究没有证明治疗组之间有统计学上的显著差异。
总结
一款药物研发在后期阶段的临床试验失败主要是由于疗效或安全性的原因,主要涉及基础科学不严谨、临床研究设计不合理、剂量选择不适合、数据收集与分析失误等方面。不过研发挫折一直是推动医药创新的动力,从失败中吸取经验,少走弯路尤为重要。除了以上5项临床试验失败案例外,强生在1月份也有临床暂停的挫折,近日在其季度更新中透露,公司已将两种早期阶段的双特异性抗体研发搁置。据药融云数据,目前全球已有8种双抗药物获批上市,其中国内有2种已经上市,全球处于三期临床阶段的还有8种,未来将有一批产品陆续上市。
参考资料:
[1] 药融云数据库vip.pharnexcloud.com/?zmt-mhwz
[2] https://www.jnj.com/janssen-and-global-partners-to-discontinue-phase-3-mosaico-hiv-vaccine-clinical-trial
[3] https://oramed.com/oramed-announces-top-line-results-from-phase-3-trial-of-ormd-0801-for-the-treatment-of-type-2-diabetes/
[4] https://ir.ocuphire.com/press-releases/detail/395/ocuphire-announces-topline-results-from-zeta-1-phase-2
[5] https://endpts.com/orameds-insulin-pill-fails-phiii-trial-in-diabetes-stock-craters/
[6] https://www.fiercepharma.com/
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入研发时提供数据参考!注册立享15天免费试用!

<END>
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论