01 默沙东:莫诺匹韦 (molnupiravir)
12月23日,美国食品药品监督管理局 (FDA) 为默沙东 (Merck) 公司的莫诺匹韦 (molnupiravir) 颁发了紧急使用授权 (EUA),用于治疗 SARS-CoV-2 病毒直接检测结果呈阳性,且有高风险发展为重症(包括住院或死亡)的成人轻中度新冠患者,这些患者 FDA 授权的 COVID-19 替代治疗方案无法获得或临床上不合适。Molnupiravir 仅可通过处方获得,应在诊断出新冠后并在症状出现后五天内尽快开始使用。

截图来源:药融云全球药物研发数据库
据药融云数据显示,莫诺匹韦(Molnupiravir)是RNAP靶点,针对感染领域的胶囊剂小分子治疗药。用于新型肺炎冠状病毒感染(COVID-19)的适应症最早于英国2021年11月获批准上市使用。另外,欧盟、美国、加拿大都已提交了上市申请,等待获批。
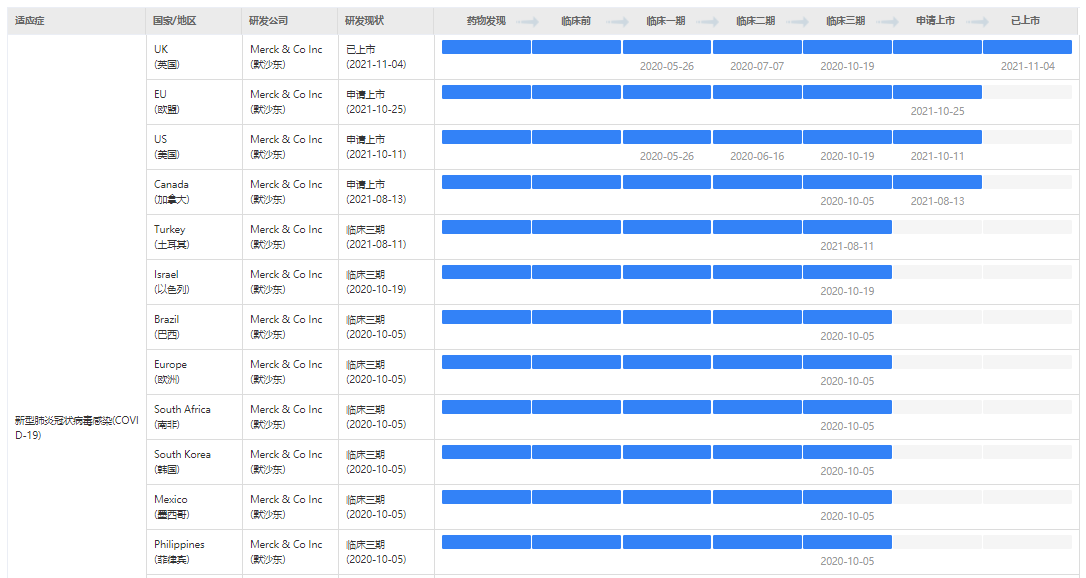
截图来源:药融云全球药物研发数据库
Molnupiravir 未被授权用于 18 岁以下的患者,因为 molnupiravir 可能会影响骨骼和软骨的生长。它未被授权用于新冠的暴露前或暴露后预防,或用于因新冠住院的患者的治疗,因为尚未在因新冠住院后给药的患者观察到获益。
“今天的授权以可口服的药丸形式提供了针对新冠病毒的额外治疗选择。Molnupiravir 仅限于无法获得 FDA 授权的其他新冠治疗方法或在临床上不合适的情况,对于某些住院或死亡风险较高的新冠患者来说,它是一种有用的治疗选择”FDA 药物评价和研究中心主任Patrizia Cavazzoni 博士说到, “随着病毒的新变种不断出现,至关重要的是使用紧急使用授权扩大该国的新冠疗法库,同时继续收集有关其安全性和有效性的更多数据。”
对于建议接种新冠疫苗和加强剂量的个体,莫努匹韦不能替代疫苗接种。
02 辉瑞 :新型抗病毒药 Paxlovid
美国时间2021 年 12 月 22 日,美国食品药品监督管理局(FDA)授予了辉瑞 (Pfizer) 新型抗病毒药 Paxlovid(PF-07321332) 紧急使用授权(EUA),该药将用于患重症 COVID-19 的高风险人群。这也是新冠领域首个获准在家使用的疗法。Paxlovid的紧急获批基于此前EPIC-HR临床研究的结果:可将感染COVID-19患者的住院或死亡的风险降低89%。
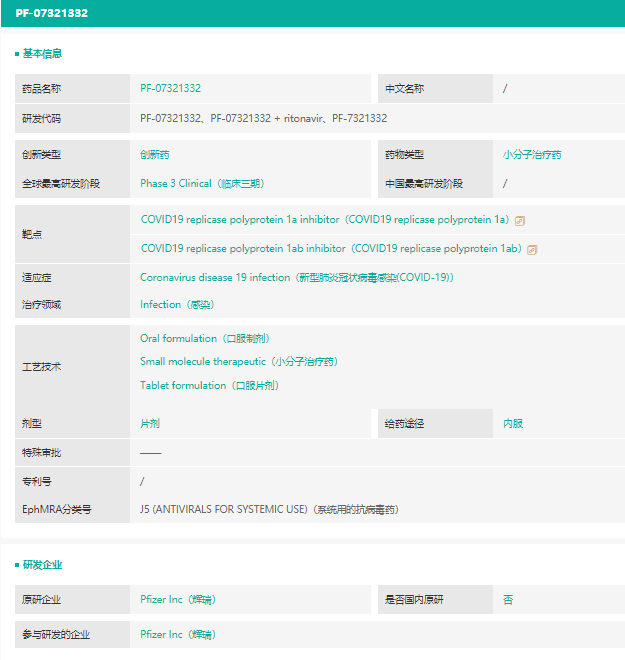
截图来源:药融云全球药物研发数据库
据药融云数据显示, Paxlovid(PF-07321332)是COVID19 replicase polyprotein 1ab inhibitor(COVID19 replicase polyprotein 1ab)靶点,针对新型肺炎冠状病毒感染的一款片剂药物。此前在10多个国家都处于临床三期阶段,现在美国被紧急使用授权。
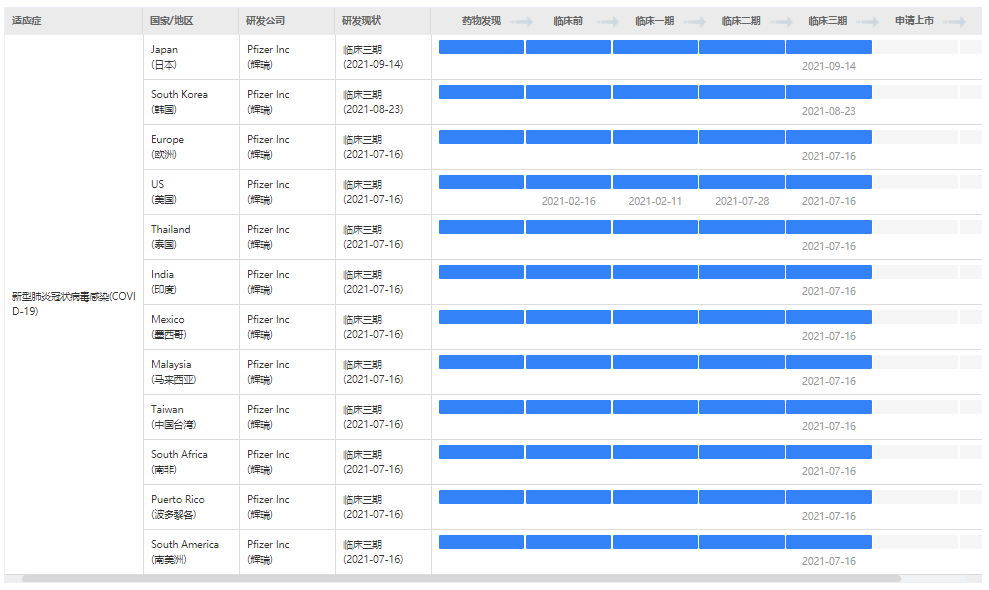
截图来源:药融云全球药物研发数据库
“今天的批准引入了首个治疗新冠的口服药,这是抗击新冠全球大流行的一项重大举措。“FDA药物评估和研究中心主任、医学博士Patrizia Cavazzoni在一份新闻稿中这样说,“随着新变种的出现, Paxlovid获批为在大流行的关键时刻抗击新冠提供了新的力量。”
辉瑞公司于今年11月中旬首次申请Paxlovid的紧急批准,随后公布了Paxlovid对预防重症COVID-19 和降低死亡风险的惊人效果。在临床试验中,服用5天的Paxlovid将高危人群的住院和死亡几率降低了近 90%。FDA 表示,Paxlovid 应在新冠感染症状出现后3~5天内服用。推荐阅读:《辉瑞新冠药物:Paxlovid,能否成为疫情的终结者?》
参考来源:
[1] FDA 官网
[2]药融云数据库





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论