
2025年2月24日,华东医药股份有限公司(以下简称“公司”)全资子公司杭州中美华东制药有限公司(以下简称“中美华东”)收到国家药品监督管理局(NMPA)核准签发的《药物临床试验批准通知书》,由中美华东申报的HDM1005注射液临床试验申请获得批准,适应症为用于阻塞性睡眠呼吸暂停(OSA)合并肥胖或超重成人患者的治疗。





2025年2月24日,华东医药股份有限公司(以下简称“公司”)全资子公司杭州中美华东制药有限公司(以下简称“中美华东”)收到国家药品监督管理局(NMPA)核准签发的《药物临床试验批准通知书》,由中美华东申报的HDM1005注射液临床试验申请获得批准,适应症为用于阻塞性睡眠呼吸暂停(OSA)合并肥胖或超重成人患者的治疗。

| 企业名称 | 申报临床 | 批准临床 | 申请上市 | 批准上市 | 一致性评价 |
|---|
据摩熵医药数据库显示,HDM1005注射液是由杭州中美华东制药有限公司研发并拥有全球知识产权的1类化学新药,是多肽类人GLP-1(胰高血糖素样肽-1)受体和GIP(葡萄糖依赖性促胰岛素多肽)受体的双靶点长效激动剂。临床前研究显示,HDM1005可通过激活GLP-1受体和GIP受体,促进环磷酸腺苷(cAMP)产生,增加胰岛素分泌,抑制食欲,延迟胃排空,改善代谢功能,进而改善血浆容量、减少氧化应激和全身炎症、改善心血管适应性;具有降糖、减重、MASH的作用。同时,现有数据显示HDM1005具有良好的成药性和安全性。
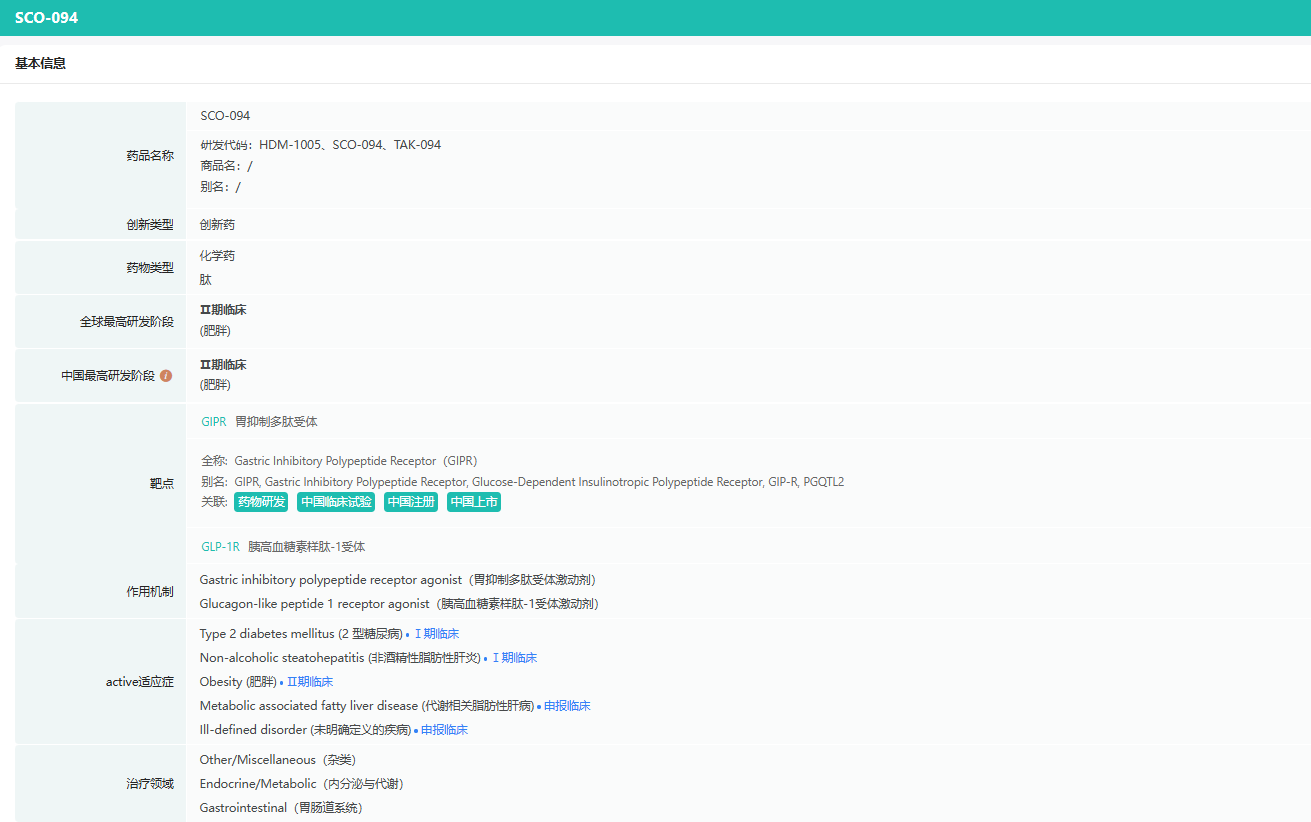
截图来源:摩熵医药全球药物研发数据库
截至目前,HDM1005注射液已在中国获批2型糖尿病、超重或肥胖人群的体重管理、代谢相关脂肪性肝病(MAFLD)/代谢相关脂肪性肝炎(MASH)以及“用于阻塞性睡眠呼吸暂停(OSA)合并肥胖或超重成人患者的治疗”多个适应症的IND;目前,HDM1005注射液在中国Ia及Ib期临床试验中取得了积极结果,正在积极推进II期临床试验相关工作(体重管理适应症II临床试验已于2025年2月完成首例受试者给药)。
HDM1005注射液的体重管理、代谢相关脂肪性肝炎、“用于OSA合并肥胖或超重患者的治疗”、“用于HFpEF合并肥胖患者的治疗”四个适应症的美国临床试验申请均已获得FDA批准。
HDM1005注射液为多肽类人GLP-1受体和GIP受体的双靶点长效激动剂,GLP-1类产品具有减肥、降糖和心血管获益等作用,是相对成熟和安全的靶点。本次HDM1005注射液临床试验获批,是该款产品研发进程中的又一重要进展,将进一步提升公司在内分泌治疗领域的核心竞争力。
参考来源:
[1] 华东医药官微
[2] 摩熵医药(原药融云)数据库
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


11093
2026年01月07日 08:00





收藏
登录后参与评论
暂无评论