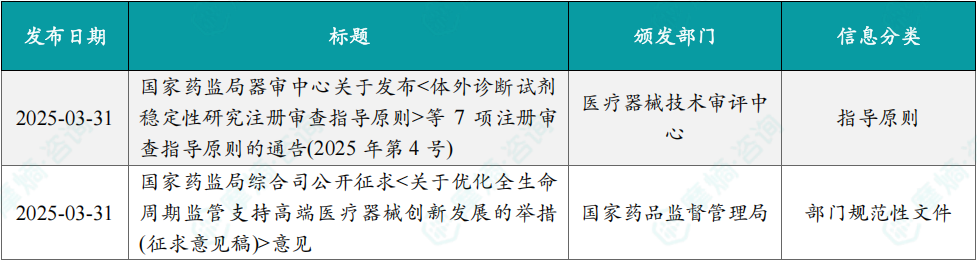
1.3.1本周国内医药大健康行业政策法规速览
1.3.2本周重点行业政策详细说明
(1)《体外诊断试剂稳定性研究注册审查指导原则》
3月31日,国家药监局器审中心组织制修订了《体外诊断试剂稳定性研究注册审查指导原则》,旨在加强医疗器械注册申报和技术审评指导。体外诊断试剂(含校准品、质控品)在制造商规定条件内(储存、运输、使用等)保持其性能特性的能力称之为稳定性,通常使用时间、次数等进行量化。
《指导原则》指出,在体外诊断试剂生产中,生产规模、环境条件、产品规格等均可能对产品稳定性产生影响。因此,待评价试剂应在保证产品原材料、生产工艺定型基础上,在质量可控的环境下进行生产。
《指导原则》列举了基于不同评价目的或研究类型,检验所需最少批次的数量,还详细阐述了评价指标、验收标准、储存条件、评价时间、试验设计、试验方案、研究报告等注册审查要点。
(2)《关于优化全生命周期监管支持高端医疗器械创新发展的举措》
3月31日,国家药监局研究并形成了《关于优化全生命周期监管支持高端医疗器械创新发展的举措(征求意见稿)》,旨在完善审评审批机制,加强全生命周期监管,全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域。
《举措》主要内容包括优化特殊审批程序、完善分类和命名规则、持续健全标准体系、进一步明晰注册审查要求、健全沟通指导机制和专家咨询机制、细化上市后监管要求、强化上市后质量监测等十方面支持举措。在优化特殊审批程序方面,《举措》指出对符合要求的国内首创、国际领先,且具有显著临床应用价值的高端医疗器械继续实施创新特别审查,进一步明确创新审查标准、优化专家评审机制,对高端创新医疗器械变更注册,按照创新特别审查程序开展审查。
同期事件:
1. 2025年第14周03.31-04.06国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第14周03.31-04.06国内仿制药/生物类似物申报/审批数据分析
3. 2025年第14周03.31-04.06全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.31-2025.04.06)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论