1.4.1本周全球TOP10创新药研发进展
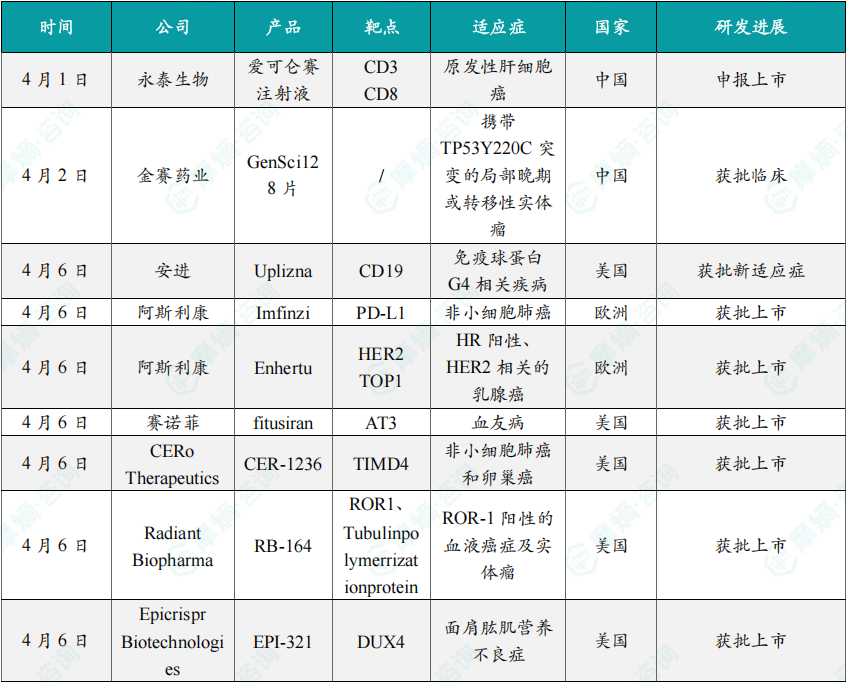
(1)永泰生物爱可仑赛注射液上市申请获NMPA受理,针对原发性肝细胞癌
4月1日,永泰生物开发的双靶点(CD3/CD8)CAR-T细胞疗法爱可仑赛注射液上市申请获中国国家药监局(NMPA)受理,该疗法针对原发性肝细胞癌(HCC)。HCC在中国是高发的恶性肿瘤,传统治疗手段有限。爱可仑赛通过基因编辑技术让T细胞同时靶向CD3和CD8抗原,增强对肿瘤细胞的识别与杀伤能力。早期临床数据显示,接受治疗患者的客观缓解率(ORR)达42%,中位总生存期(OS)延长至16.8个月,显著优于现有疗法,且安全性良好,未报告严重细胞因子释放综合征(CRS)。若获批,爱可仑赛将成为全球首个针对HCC的双靶点CAR-T产品,填补国内肝癌免疫治疗领域空白。永泰生物计划开展国际多中心III期试验,推进全球化布局。
(2)金赛药业GenSci128片获NMPA批准开展临床试验,靶向TP53Y220C突变
4月2日,金赛药业研发的靶向TP53Y220C突变的小分子抑制剂GenSci128片获中国NMPA批准开展临床试验。TP53作为重要的抑癌基因,其Y220C突变常见于肺癌、乳腺癌等多种实体瘤,会致使p53蛋白功能丧失。GenSci128能够通过稳定突变p53蛋白结构,恢复其抑癌活性。临床前研究表明,在携带Y220C突变的异种移植模型中,该药物可使肿瘤体积缩小率达70%,且对正常细胞毒性较低。此次获批开展的I期试验,将对其安全性及初步疗效进行评估。若试验成功,GenSci128有望成为全球首个针对TP53Y220C突变的精准疗法,为那些缺乏靶向治疗选择的患者提供全新治疗方向。金赛药业还计划与美国生物技术公司展开合作,以加速GenSci128的国际化开发进程。
(3)安进抗CD19单抗Uplizna获FDA批准用于治疗IgG4相关疾病
4月6日,安进旗下的抗CD19单抗Uplizna(inebilizumab)获FDA批准,用于治疗免疫球蛋白G4相关疾病(IgG4-RD)。IgG4-RD属于慢性炎症性疾病,可累及胰腺、泪腺等众多器官。以往传统治疗主要依靠糖皮质激素,然而复发率居高不下。Uplizna作用机制为耗竭CD19+B细胞,从而阻断自身抗体生成。关键的III期MITIGATE试验结果显示,治疗组在52周时的复发率仅为3%,而对照组高达81%,同时该药物耐受性良好。此次获批让Uplizna成为全球首个针对IgG4-RD的靶向疗法。后续,安进计划将Uplizna的适应症扩展至视神经脊髓炎谱系疾病(NMOSD),并且探索与IL-6抑制剂的联用方案,以此巩固自身在自身免疫病领域的领先地位。
(4)阿斯利康Imfinzi获欧盟批准,用于特定III期非小细胞肺癌巩固治疗
4月6日,Imfinzi再次获得欧盟批准,可用于PD-L1高表达(≥50%)的不可切除III期非小细胞肺癌(NSCLC)患者的巩固治疗。这一适应症的获批基于PACIFIC-2III期试验数据,数据表明Imfinzi联合同步放化疗,能将患者3年无进展生存率提升至55%(对照组为33%),中位总生存期延长至47.5个月。此次获批进一步拓宽了Imfinzi在肺癌领域的应用范围,覆盖从局部晚期到转移性NSCLC的整个病程。阿斯利康还打算探索Imfinzi与新型免疫疗法(例如CTLA-4抑制剂)的联合方案,期望借此提升治疗效果并克服耐药性问题。
(5)阿斯利康Enhertu获欧盟批准用于HR阳HER2低表达乳腺癌二线治疗
4月6日,阿斯利康与第一三共联合开发的HER2靶向ADC药物Enhertu(德曲妥珠单抗)获欧盟批准,用于HR阳性、HER2低表达乳腺癌的二线治疗。DESTINY-Breast06III期试验表明,Enhertu组中位无进展生存期(PFS)达13.2个月(对照组为8.1个月),疾病进展风险降低38%。其因载药为拓扑异构酶I抑制剂的独特设计,能够穿透肿瘤微环境,发挥“旁观者效应”。此次获批意味着HER2低表达乳腺癌正式迈入精准治疗时代。阿斯利康正在推进Enhertu在胃癌、肺癌等适应症的全球申报工作,预计2025年销售额将突破50亿美元。
(6)赛诺菲siRNA疗法Fitusiran获FDA批准用于血友病A/B预防治疗
4月6日,赛诺菲研发的靶向抗凝血酶III(AT3)的siRNA疗法Fitusiran获FDA批准,用于血友病A/B患者的常规预防治疗。Fitusiran通过抑制AT3合成,恢复凝血酶生成平衡。关键III期ATLAS-A/B试验表明,每月一次皮下注射能将年化出血率降低89%,且患者无需频繁输注凝血因子。此次获批,使Fitusiran成为首个适用于所有血友病亚型的非因子替代疗法。赛诺菲计划探索Fitusiran与基因疗法的联用方案,旨在进一步延长疗效持续时间并减轻患者治疗负担。
(7)CERo公司TIMD4抑制剂CER-1236获FDA加速批准用于多癌种治疗
4月6日,CERo Therapeutics开发的首创TIMD4抑制剂CER-1236获FDA加速批准,可用于TIMD4高表达的非小细胞肺癌(NSCLC)和卵巢癌治疗。在肿瘤微环境中,TIMD4会通过抑制T细胞功能来促进免疫逃逸。I/II期试验结果显示,CER-1236单药治疗的客观缓解率(ORR)为31%,联合PD-1抑制剂后提升至48%。此次获批是基于“篮子试验”设计,覆盖了多种瘤种适应症。CERo Therapeutics计划启动全球III期验证性试验,同时探索CER-1236在前列腺癌中的应用可能性。
(8)Radiant公司ROR1靶向CAR-T疗法R-B164获FDA多癌种批准
4月6日,Radiant Biopharma研发的ROR1靶向CAR-T疗法R-B164获FDA批准,用于治疗ROR1阳性血液癌及实体瘤。ROR1在众多恶性肿瘤中呈现高表达状态,而在正常组织中几乎不表达。I期试验数据表明,R-B164在复发/难治性慢性淋巴细胞白血病(CLL)中的完全缓解率高达58%,并且在实体瘤(如三阴性乳腺癌)中也观察到部分缓解效果。该疗法独特之处在于采用了“安全开关”机制,能够有效降低细胞因子风暴风险。RadiantBiopharma计划与跨国药企展开合作,以推动R-B164的全球化商业布局。
(9)Epicrispr基因疗法EPI-321获FDA批准用于面肩肱肌营养不良症
4月6日,Epicrispr Biotechnologies基于CRISPR技术开发的基因疗法EPI-321,获FDA批准用于治疗面肩肱肌营养不良症(FSHD)。FSHD由DUX4基因异常表达引发肌肉萎缩。EPI-321靶向DUX4基因座,可永久性沉默其表达。I/II期试验表明,患者肌肉功能评分改善40%,且无严重脱靶效应。此次获批让它成为全球首个FSHD基因疗法。Epicrispr计划将其适应症拓展至其他遗传性肌病,并探索与AAV载体联合递送方案。
1.4.2本周全球TOP10积极/失败临床结果
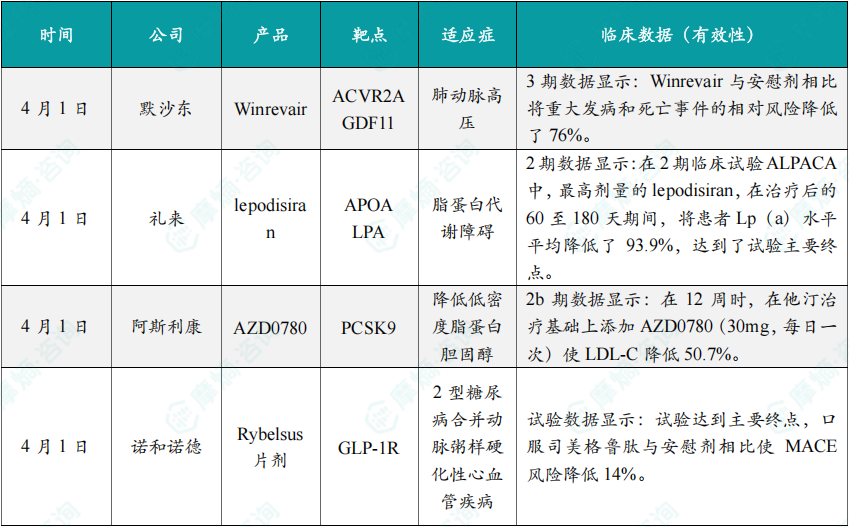
(1)默沙东旗下产品Winrevair在肺动脉高压3期临床中显著降低风险
4月1日,默沙东公布了其创新药物Winrevair(ACVR2A靶点)在肺动脉高压(PAH)治疗中的最新临床数据。Winrevair是一种针对ACVR2A的单克隆抗体,通过阻断GDF11信号通路,抑制血管平滑肌细胞的增殖和迁移,从而改善肺血管重构。在3期临床试验中,Winrevair与安慰剂相比,显著降低了重大发病和死亡事件的相对风险达76%。这一结果表明,Winrevair在改善肺动脉高压患者的生存质量和长期预后方面具有显著优势。
(2)礼来旗下产品lepodisiran在脂蛋白代谢障碍2期临床中大幅降低Lp(a)水平
4月1日,礼来公司公布了其创新药物lepodisiran在脂蛋白代谢障碍治疗中的最新临床数据。Lepodisiran是一种针对APOA靶点的小分子药物,通过抑制LPA(脂蛋白a)的合成,显著降低患者血液中Lp(a)水平。在2期临床试验ALPACA中,最高剂量的lepodisiran在治疗后的60至180天期间,将患者Lp(a)水平平均降低了93.9%,并达到了试验的主要终点。这一结果为lepodisiran的进一步开发提供了强有力的支持。礼来计划启动3期临床试验,目标是验证其在心血管疾病高风险人群中的长期疗效和安全性。
(3)阿斯利康宣布其AZD0780在降低LDL-C2b期临床中展现显著疗效
4月1日,阿斯利康公布了其新型PCSK9抑制剂AZD0780的2b期临床试验数据。AZD0780是一种口服小分子药物,通过抑制PCSK9的活性,增强肝脏对低密度脂蛋白胆固醇(LDL-C)的清除能力。在12周的试验中,AZD0780(30mg,每日一次)在他汀治疗基础上进一步降低了LDL-C水平达50.7%。这一结果表明,AZD0780在降低心血管疾病风险方面具有显著潜力。阿斯利康计划启动3期临床试验,以验证其在更广泛患者群体中的疗效和安全性。
(4)诺和诺德宣布其Rybelsus片剂在2型糖尿病心血管疾病临床中降低MACE风险
4月1日,诺和诺德公布了其口服GLP-1受体激动剂Rybelsus(司美格鲁肽)在2型糖尿病合并动脉粥样硬化性心血管疾病(ASCVD)患者中的最新临床数据。在关键试验中,口服司美格鲁肽与安慰剂相比,显著降低了主要心血管不良事件(MACE)的风险达14%。这一结果进一步巩固了Rybelsus在心血管疾病预防中的地位。诺和诺德计划在2024年内向全球主要市场提交Rybelsus的新适应症申请,预计将在2025年获得批准。
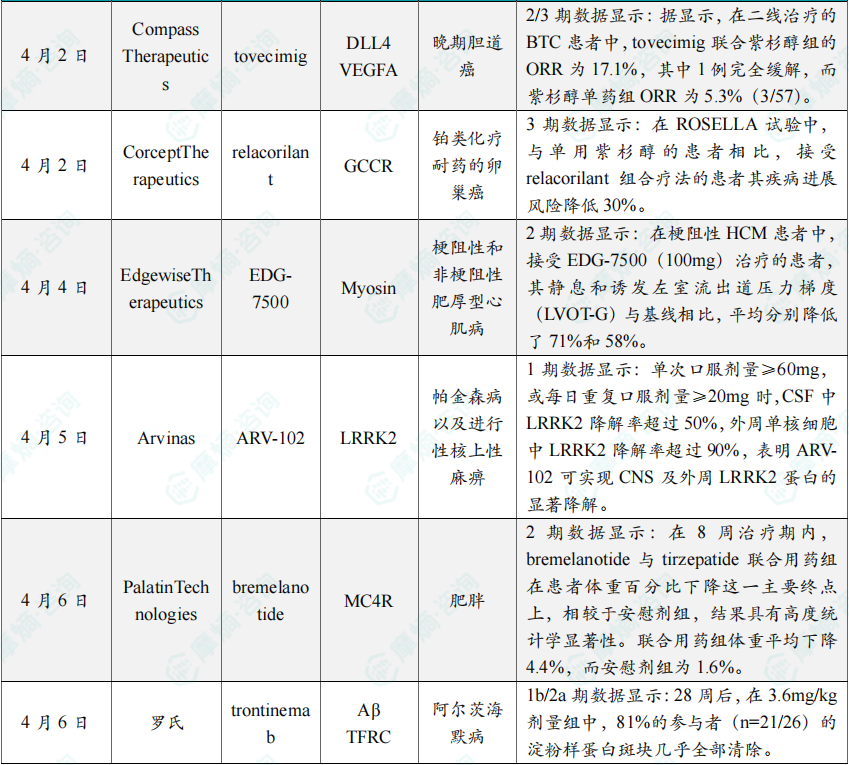
(5)Compass公司tovecimig在晚期胆道癌2/3期临床中提升客观缓解率
4月2日,Compass Therapeutics公布了其创新药物tovecimig在晚期胆道癌(BTC)治疗中的2/3期临床试验数据。Tovecimig是一种双靶点抑制剂,通过同时阻断DLL4和VEGFA信号通路,抑制肿瘤血管生成和肿瘤细胞增殖。在二线治疗的BTC患者中,tovecimig联合紫杉醇组的客观缓解率(ORR)为17.1%,其中包括1例完全缓解,而紫杉醇单药组的ORR仅为5.3%。这一结果表明,tovecimig在晚期胆道癌治疗中具有显著的协同作用。Compass计划启动更大规模的3期临床试验,以进一步验证其疗效和安全性。
(6)Corcept产品relacorilant在卵巢癌3期临床中降低疾病进展风险
4月2日,Corcept Therapeutics公布了其创新药物relacorilant在铂类化疗耐药卵巢癌治疗中的3期临床试验数据。Relacorilant是一种选择性糖皮质激素受体拮抗剂(GCCR),通过阻断糖皮质激素信号通路,抑制肿瘤细胞的增殖和耐药性。在ROSELLA试验中,与单用紫杉醇的患者相比,接受relacorilant联合疗法的患者疾病进展风险降低了30%。这一结果为relacorilant的上市申请提供了关键支持。
(7)Edgewise Therapeutics产品EDG-7500在肥厚型心肌病2期临床中显著改善压力梯度
4月4日,Edgewise Therapeutics公布了其创新药物EDG-7500在梗阻性和非梗阻性肥厚型心肌病(HCM)治疗中的2期临床试验数据。EDG-7500是一种心肌肌球蛋白激活剂,通过增强心肌收缩力,改善心脏功能。在2期试验中,接受EDG-7500(100mg)治疗的梗阻性HCM患者,其静息和诱发左室流出道压力梯度(LVOT-G)与基线相比,分别降低了71%和58%。这一结果表明,EDG-7500在改善HCM患者症状和生活质量方面具有显著潜力。Edgewise计划在2025年启动3期临床试验,以进一步验证其疗效和安全性。
(8)Arvinas公司ARV-102在帕金森病及进行性核上性麻痹1期临床中实现LRRK2降解
4月5日,Arvinas公布了其创新药物ARV-102在帕金森病(PD)和进行性核上性麻痹(PSP)治疗中的1期临床试验数据。ARV-102是一种PROTAC分子,通过靶向降解LRRK2蛋白,抑制其过度活性,从而改善神经退行性病变。在1期试验中,单次口服剂量≥60mg或每日重复口服剂量≥20mg时,脑脊液(CSF)中LRRK2降解率超过50%,外周单核细胞中LRRK2降解率超过90%。这一结果表明,ARV-102在中枢神经系统(CNS)和外周系统中均能显著降解LRRK2蛋白。Arvinas计划在2025年启动2期临床试验,以验证其在更大患者群体中的疗效和安全性。
(9)Palatin公司bremelanotide在肥胖2期临床中联合用药显著减重
4月6日,Palatin Technologies公布了其创新药物bremelanotide在肥胖治疗中的2期临床试验数据。Bremelanotide是一种MC4R激动剂,通过激活中枢神经系统中的MC4受体,抑制食欲并增加能量消耗。在8周的试验中,bremelanotide与tirzepatide联合用药组在患者体重百分比下降这一主要终点上,相较于安慰剂组,结果具有高度统计学显著性。联合用药组体重平均下降4.4%,而安慰剂组仅为1.6%。这一结果表明,bremelanotide在肥胖治疗中具有显著的协同作用。Palatin计划在2025年启动3期临床试验,以进一步验证其疗效和安全性。
(10)罗氏宣布其产品trontinemab在阿尔茨海默病1b/2a期临床中清除淀粉样蛋白斑块
4月6日,罗氏公布了其创新药物trontinemab在阿尔茨海默病(AD)治疗中的1b/2a期临床试验数据。Trontinemab是一种双靶点抗体,通过同时靶向Aβ和TFRC,清除大脑中的淀粉样蛋白斑块并改善神经功能。在1b/2a期试验中,28周后,在3.6mg/kg剂量组中,81%的参与者(n=21/26)的淀粉样蛋白斑块几乎全部清除。这一结果表明,trontinemab在早期AD患者中具有显著的治疗潜力。罗氏计划在2025年启动2b期临床试验,以进一步验证其疗效和安全性。
同期事件:
1. 2025年第14周03.31-04.06国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第14周03.31-04.06国内仿制药/生物类似物申报/审批数据分析
3. 2025年第14周03.31-04.06国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.31-2025.04.06)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论