
2月6日,云顶新耀 宣布,中国国家药监局(NMPA)正式批准 艾曲莫德(VELSIPITY®,曾用名:伊曲莫德)上市,用于治疗对传统治疗或生物制剂应答不充分、失应答或不耐受的中度至重度活动性溃疡性结肠炎(UC)成人患者。这一消息标志着云顶新耀在自身免疫性疾病赛道迎来又一里程碑式进展。
全球布局多年,艾曲莫德成自免领域新星
艾曲莫德 是一款每日一次口服的新一代高选择性鞘氨醇-1-磷酸(S1P)受体调节剂,采用优化的药理学设计,能够与 S1P 1、4 和 5 受体结合,同时避开亚型2和3,提供全身和局部细胞调节,具有快速起效和快速T淋巴细胞恢复的特点。其核心优势在于快速起效并能促使T淋巴细胞快速恢复,兼顾疗效与安全性。

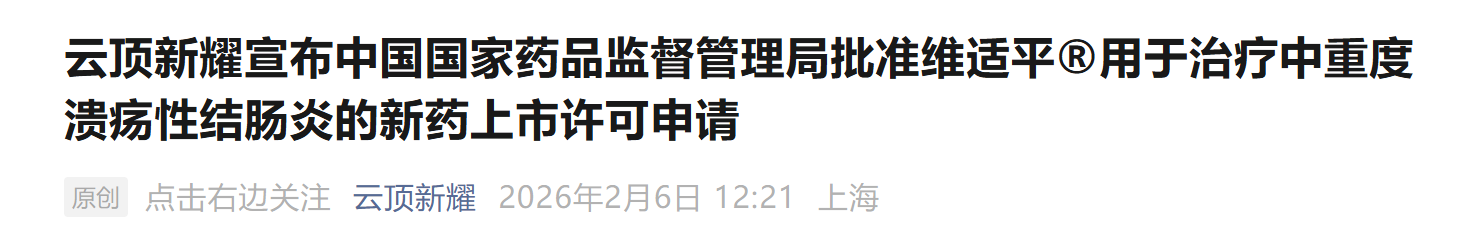
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
据摩熵医药数据库显示,早在2017年12月,云顶新耀便以2.24亿美元的总交易额,获得艾曲莫德在大中华区及韩国的独家开发、生产与商业化权利。
2021年12月,辉瑞 以总价67亿美元收购Arena Pharmaceuticals,将 艾曲莫德 的全球剩余权益收入囊中,进一步加速其国际化进程。
2023年10月,艾曲莫德片剂(2mg,每日1次,商品名:Velsipity)率先在美国获批上市,用于成人中度至重度活动性UC,开启全球商业化序幕。
2024年7月,云顶新耀公布 艾曲莫德 治疗UC的亚洲多中心III期临床研究(ENLIGHT UC)取得积极顶线结果,为该药在中国及亚洲其他市场的注册与上市奠定坚实基础。
海内外多地获批,临床证据持续夯实
作为云顶新耀在自身免疫性疾病领域的重磅产品,艾曲莫德 不仅能够强效促进肠道黏膜愈合,还具备使用便捷(每日一次口服)与良好安全性特征。此前,该药已先后在美国、欧盟、加拿大、日本、澳大利亚、英国、瑞士、以色列,以及中国澳门、新加坡和中国香港获得新药上市批准,全球化版图不断扩展。
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
更值得关注的是,在2025年7月召开的第13届亚洲炎症性肠病组织年会上,云顶新耀公布了 艾曲莫德 的全球4年安全性研究成果。该研究覆盖1196例UC患者,累计随访达1619.5人年,最长单例治疗随访时间约4年(208.9周)。数据再次以大规模、长周期的临床证据,验证其在真实世界中的耐受性与安全性,为长期用药提供有力支撑。
百亿自免赛道扩容,艾曲莫德抢占先机
溃疡性结肠炎作为炎症性肠病的主要类型之一,患者基数庞大且呈逐年上升趋势,驱动全球及中国自免药物市场快速增长。据Frost & Sullivan数据,全球自免药物市场近年来保持稳健扩容,中国UC治疗可及性提升与新型靶点药物的落地,为患者带来更多选择。艾曲莫德 凭借口服便利、起效快、安全性佳等优势,有望在这一细分领域快速放量。
在国内UC药物竞争格局中,传统治疗方案仍以氨基水杨酸类、糖皮质激素及生物制剂为主,但部分患者存在耐药、不耐受或应答不足的问题。艾曲莫德 的问世,为这类难治性患者提供了新的治疗路径,也为云顶新耀在自免管线竞争中构筑差异化优势。
小结
艾曲莫德 在中国的获批,不仅是云顶新耀全球化研发与商业策略的成果体现,也意味着国内UC治疗格局将迎来重要变化。依托扎实的全球临床试验数据与广泛的市场准入基础,该药有望迅速覆盖目标患者群体,提升治疗依从性与生活质量。
参考来源:
[1] 企业官微
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 2026年IgA肾病药物市场格局:6款药物争霸百亿市场,诺华、云顶新耀领跑
2. 云顶新耀携手海森生物!6款成熟原研药+PCSK9新药莱达西贝普协同布局,共绘慢病与心血管领域新蓝图
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论