
2022年9月21日,生物制药公司Inventiva发布公告,与中国生物制药的子公司正大天晴药业集团有限公司签订许可和合作协议,开发和商业化泛PPAR激动剂lanifibranor,用于治疗中国大陆、香港、澳门和台湾(大中华区)的非酒精性脂肪性肝炎(NASH)和潜在的其他代谢疾病。目前,国内暂无针对该慢性肝病的新药获批上市。

作为获得在大中华区开发、进口、制造、商业化和营销lanifibranor的独家许可的交换条件,正大天晴将向Inventiva支付1200万美元的预付款,如果达到某些临床里程碑,预计短期内还将支付500万美元。根据协议条款,Inventiva 有可能获得正大天晴合计支付高达2.9亿美元的临床、监管和商业里程碑付款。
据药融云数据显示,Lanifibranor是由Inventiva首创的泛PPAR激动剂,也是目前唯一正在临床开发的泛PPAR激动剂。据悉,Lanifibranor可激活PPAR的全部3种亚型α、γ、δ。前期研究表明,lanifibranor可以改善胰岛素敏感性和巨噬细胞活化,减少肝纤维化和炎症基因表达,其疗效高于单一或双PPAR激动剂。
Lanifibranor基本信息 (微信搜索"药融云小程序"进行相关更多数据查询)
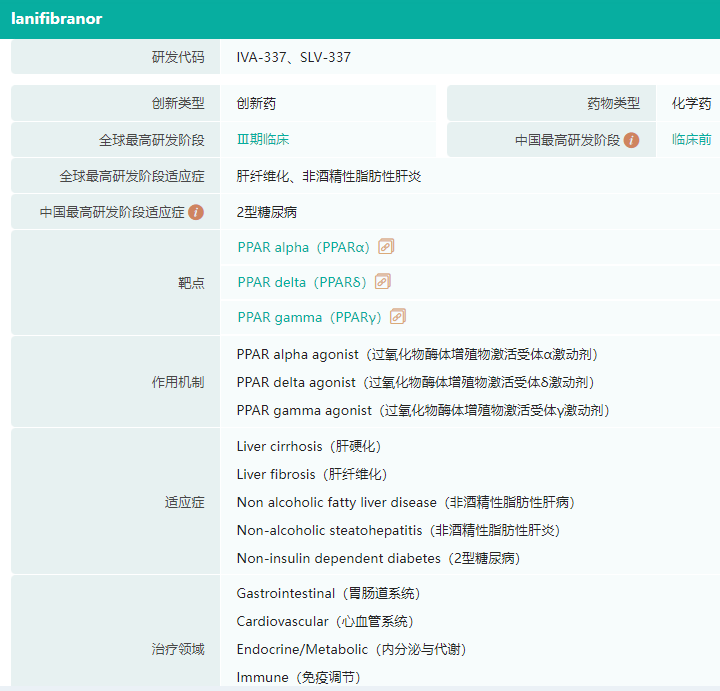
截图来源:药融云全球药物研发数据库
在IIb期临床研究中,在lanifibranor 1200mg、800mg剂量组和安慰剂组中,非酒精性脂肪性肝炎(NASH)逆转且纤维化无恶化的比例分别为49% 、39%、22%;纤维化改善至少1级且NASH无恶化的比例分别为48%、34%、29%;NASH逆转且纤维化改善至少1级的比例分别为35%、25%、9%。另外lanifibranor安全性好,有望成为NASH领域的一款潜力药物。
lanifibranor显著改善脂肪变性和气球样变
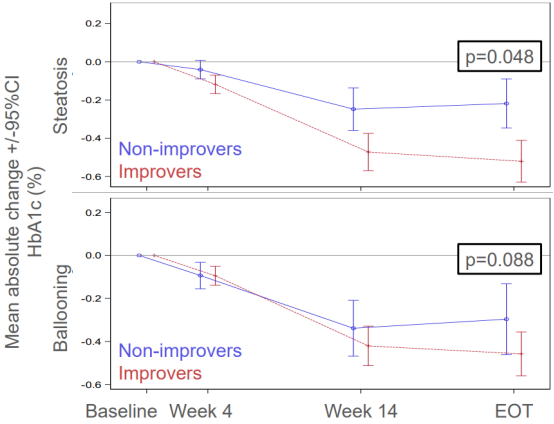
$400亿慢性肝病市场,康哲药业、微芯生物……国内领先
非酒精性脂肪性肝炎(NASH)是脂肪在肝脏中过度积累形成的一种慢性进行性肝病,由脂肪组织胰岛素抵抗、脂肪细胞因子失衡和全身炎症共同导致,是目前世界范围内慢性肝病的主要原因,可能最终进展为肝硬化、肝细胞癌、肝移植、心血管疾病恶化及代谢功能障碍。
与糖尿病、癌症等跨越了百年甚至千年的疾病相比,NASH是一种非常“年轻”的疾病,只有四十岁龄。据全球肝脏研究所(Global Liver Institute)数据显示,预计到2030年,全球将有3.57亿人的生活受到NASH的影响。据Evaluate Pharm预测,2025年全球NASH药物的市场规模可达400亿美元。
在大型慢性病领域,血压、血脂、血糖领域一个个被攻克,又一个个变成红海,NASH市场却尚待开垦。目前NASH的药物研发主要是围绕FXR(法尼醇 X 受体)激动剂、PPAR激动剂、FGF 21(成纤维细胞生长因子21)、IBAT抑制剂、CCR2/5抑制剂等来开展。参与布局的国产企业中,又以西安新通医学系统有限公司、深圳市康哲药业、深圳微芯生物、广东东阳光药业等进展较快,已至II/III期临床阶段。
II/III期临床阶段的国产NASH在研新药
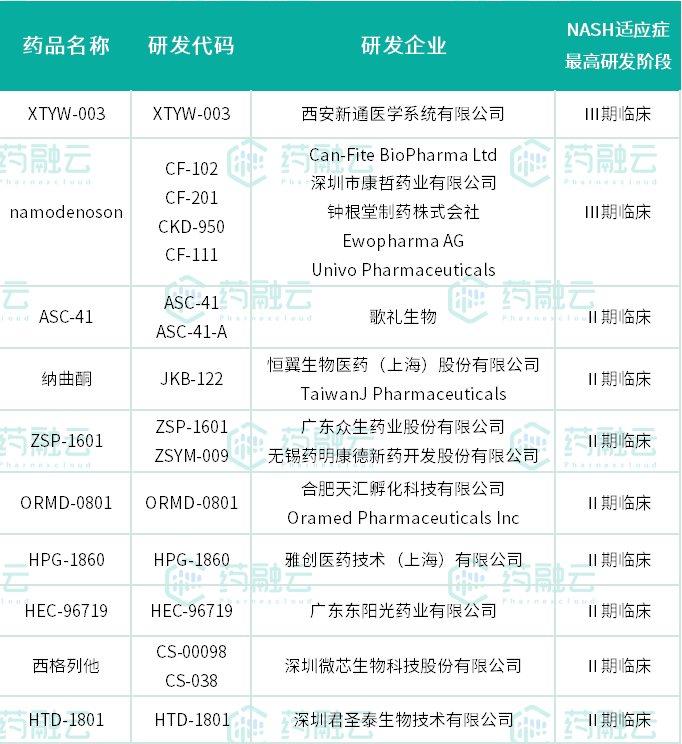
数据来源:药融云全球药物研发数据库
目前来看,NASH的新药研发失败现象如“家常便饭”:除了印度药企Zydus-Cadila Group开发的saroglitazar magnesium获批上市(目前仅在印度市场获批,该药NASH适应症在美国尚处于2期临床阶段)外,并无其他针对性药物获批)。
saroglitazar magnesium部分研发现状
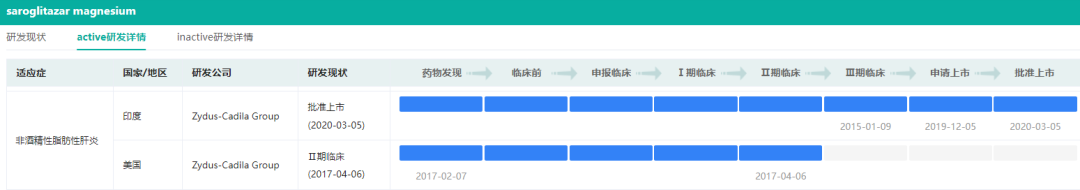
截图来源:药融云全球药物研发数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、销售情况与市场前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论