
实时了解国产创新药全球化最新动态、全球在研创新药积极/失败临床结果动态,尽在药融云《全球在研新药与靶点月报》。据药融云8月《全球在研新药与靶点月报》统计,本月有50余家药企在研新药的临床试验达主要终点/获积极临床结果,值得重点关注;还有近20款国产创新药的全球化进程有了新进展,国产创新药企“出海”加速。
一、全球在研创新药积极/失败临床结果动态
1.有望延缓衰老过程,创新口服疗法达到2期临床终点
MyMDPharmaceuticals发布的最新研究结果显示,其开发的口服肿瘤坏死因子-α(TNF-α)抑制剂MYMD-1在随机2期临床试验中取得了统计学上显著的积极成果。在患有肌肉减少症(sarcopenia)或由年龄相关虚弱引发的慢性炎症的患者中,MYMD-1成功实现了显著降低受试者慢性炎症生物标志物的主要目标。
TNF-α是慢性炎症的主要驱动因素,而MYMD-1则是一种特异性的TNF-α抑制剂。研究数据表明,MYMD-1具有延缓衰老进程、预防肌肉减少症和虚弱,并延长健康寿命的潜力。与目前可用的TNF-α抑制剂相比,MYMD-1的显著优势在于其方便的口服给药方式,这为患者提供了更为便利的治疗选择。
MYMD-1(试验登记号NCT05283486)临床试验结果
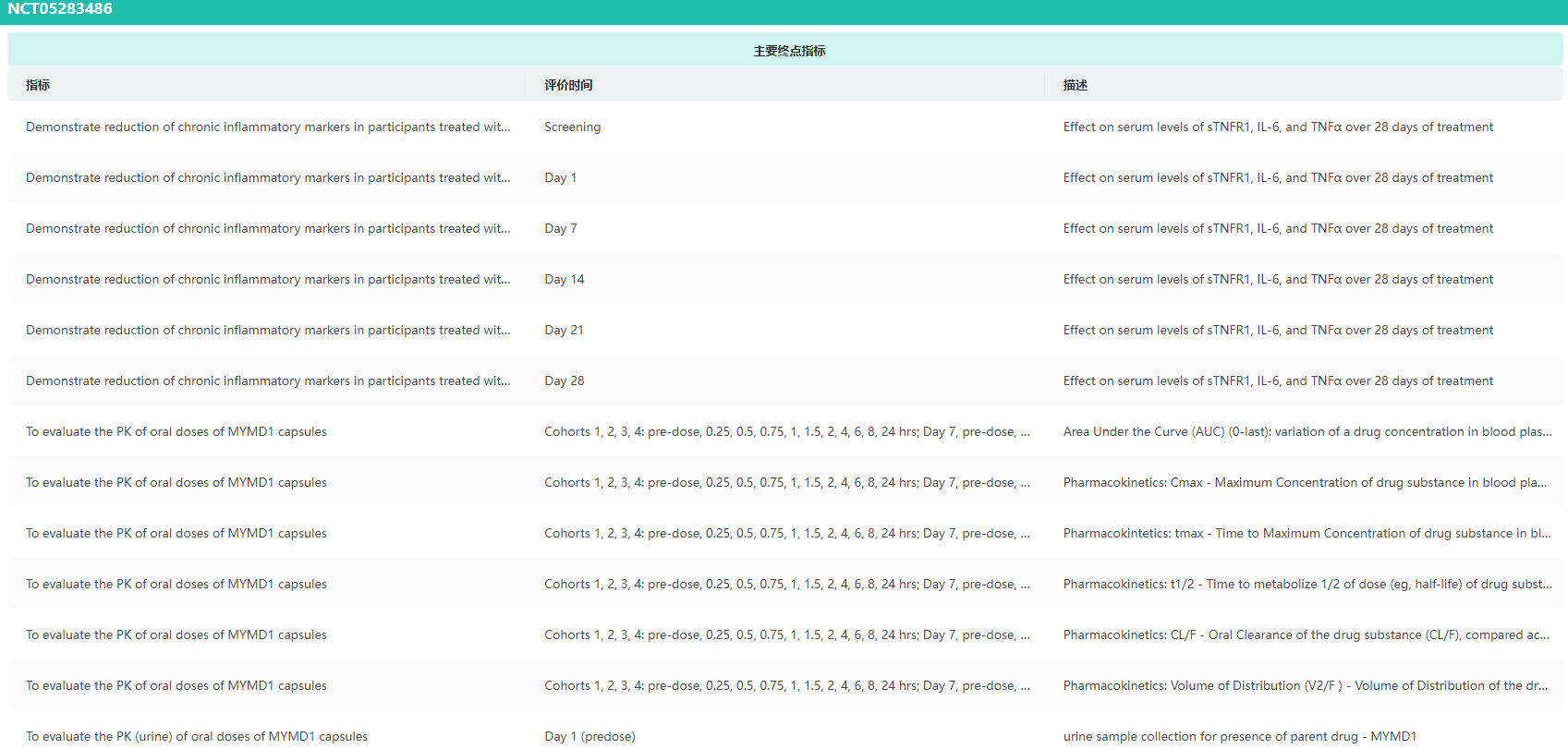
图片来源:药融云临床试验结果数据库
药融云全球临床试验数据库显示,MYMD-1在调节免疫系统的临床前和临床研究阶段就已显示出其有效性。具体而言,MYMD-1能够在TNF-α信号通路过度激活的情况下(例如自身免疫性疾病和细胞因子风暴)选择性地阻断TNF-α的作用,同时不干扰TNF-α针对感染的正常反应机制。
更令人兴奋的是,目前尚未发现MYMD-1会引起传统免疫抑制疗法的常见严重副作用,这使得MYMD-1在安全性方面表现良好。该研究达到了两个主要终点,显著降低了三种关键生物标志物——TNF-α(P=0.008)、sTNFR1(P=0.02)和IL-6(P=0.03)的血清水平。
同时,在药代动力学评估中,MYMD-1也维持了适当的血浆浓度和参数。重要的是,该研究还达到了所有与安全性和耐受性相关的次要终点。整个研究过程中,未发生任何与治疗相关的严重不良事件(SAE)。
这些结果显示出MYMD-1在治疗慢性炎症性疾病方面的巨大潜力,尤其是对于患有肌肉减少症或由年龄相关虚弱引发的疾病的患者。MYMD-1的成功研发不仅可能改变慢性炎症性疾病的治疗格局,更为全球数亿的慢性炎症患者带来了新的治疗希望。
2.恒瑞医药抗PD-1单抗2期临床获积极结果
恒瑞医药的创新药卡瑞利珠单抗联合化疗(Cam+CT)对比化疗(CT)新辅助治疗ⅢA/ⅢB(T3N2)期非小细胞肺癌(NSCLC)的2期临床研究(TD-FOREKNOW)结果在线发表于JAMAOncology。
ⅢA/ⅢB期非小细胞肺癌是一组具有高度异质性的疾病,新辅助治疗联合手术可作为这部分患者的治疗选择之一,但新辅助治疗模式仍有待进一步探究。抗PD-1/PD-L1抗体的免疫检查点抑制剂(ICIs)已经改变了晚期NSCLC的治疗模式,且逐步应用到围手术期治疗中。
卡瑞利珠单抗全球临床试验查询
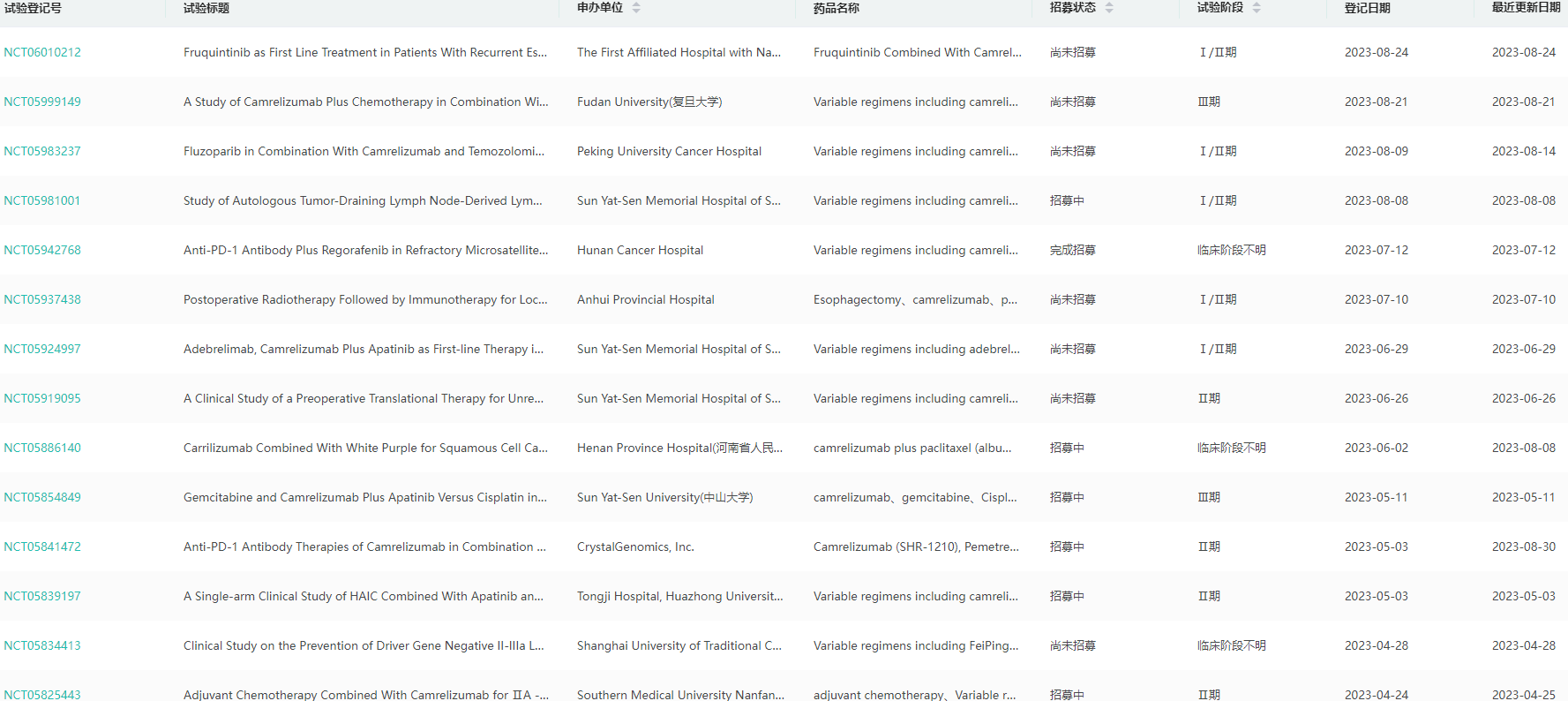
图片来源:药融云全球临床试验数据库
卡瑞利珠单抗是一种人源化的靶向PD-1的IgG4-κ单克隆抗体。此次发表的TD-FOREKNOW研究旨在评估卡瑞利珠单抗联合化疗对比化疗在NSCLC新辅助治疗中的疗效和安全性。分析显示,与化疗相比,卡瑞利珠单抗联合化疗显著提高了患者的pCR率(32.6%vs8.9%);同时也改善了患者的MPR率(65.1%vs15.6%)和ORR(72.1%vs53.3%)。截至2022年8月31日,EFS暂未成熟,Cam+CT组1年和2年的EFS率分别达到93.0%和76.9%,CT组则为76.9%和67.6%。
药融云全国医院销售(全终端)数据库显示,卡瑞利珠单抗2022年在全国医院端的销售额达到24.14亿元。卡瑞利珠单抗(商品名:艾瑞卡),是恒瑞医药自主研发的人源化PD-1单克隆抗体。自2019年5月获得上市批准以来,已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中成功获得9个适应症的批准,成为目前获批适应症最多的国产PD-1产品之一。
卡瑞利珠单抗获批上市的适应症查询
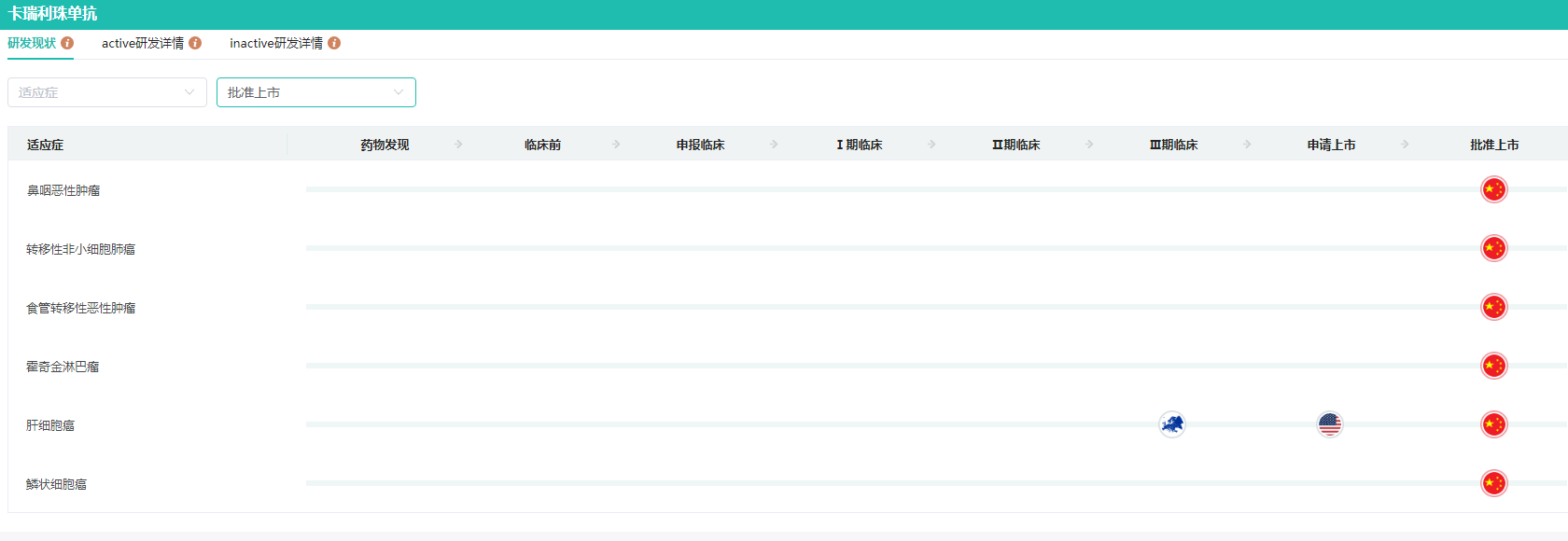
图片来源:药融云全球药物研发数据库
在国内PD-1市场中,卡瑞利珠单抗占有很高的市场份额,处于龙头位置,也是恒瑞医药目前最大的创新药单品。2023年,恒瑞医药的抗PD-L1单抗阿得贝利单抗(SHR-1316)注射液获批上市,使得恒瑞医药成为全球唯一一家同时拥有PD-1和PD-L1两大单抗的药企。
3. 科伦博泰TROP2-ADC疗法3期临床达主要终点
科伦博泰宣布,其靶向TROP2-ADC产品SKB264(MK-2870)用于治疗既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌(TNBC)患者的3期临床试验达到主要研究终点。这一重要的研究终点标志着SKB264在针对TNBC患者的治疗中取得了关键性的进展。
SKB264是由科伦博泰研发的一款创新抗体偶联药物(ADC),由靶向TROP-2的人源化单克隆抗体、可酶促裂解的Linker和新型拓扑异构酶I抑制剂组成。这种药物的设计精巧且具有高度创新性,其专有毒素-连接子策略(Kthiol设计策略)将新型不可逆的抗体偶联技术、pH敏感毒素释放机制和均匀加载DAR7.4的中等活性毒素(新型拓扑异构酶I抑制剂)相结合,使ADC的安全性和有效性得到了优化平衡。
SKB264中国临床试验查询
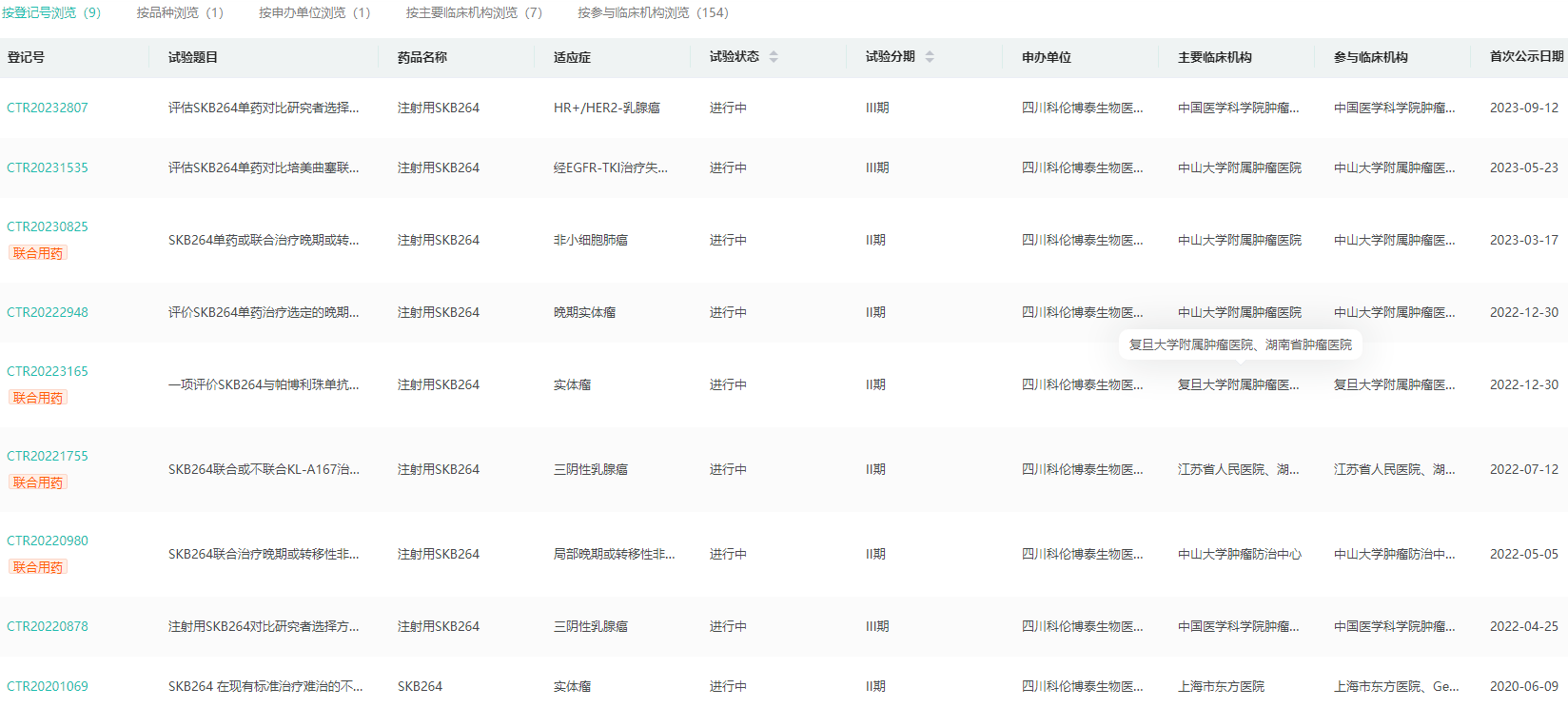
图片来源:药融云中国临床试验数据库
本次达到主要终点的3期研究是SKB264在中国的首个注册研究,这一研究对于SKB264在全球范围内的注册和商业化具有重要意义。这项多中心、随机、对照、开放性试验旨在对比SKB264与研究者选择的方案对于既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌患者的疗效。分析显示,在预先设定的期中分析中,与接受标准化疗的对照组相比,SKB264(MK-2870)在无进展生存期方面有统计学上的显著改善,这一结果无疑为三阴性乳腺癌患者提供了一种新的、更有效的治疗选择。
二、国产创新药国际化动态
1. 亚盛医药Bcl-2抑制剂在美国获批关键3期临床
亚盛医药宣布,美国FDA已批准其核心产品Bcl-2选择性抑制剂lisaftoclax(APG-2575)开展一项全球关键注册性3期临床研究,旨在治疗既往接受治疗的慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)患者。
CLL/SLL是成人白血病的常见类型,全球每年新增病例超过10万例。尽管当前的一线治疗如免疫疗法、化疗和BTK抑制剂对初治患者有显著反应,但复发和耐药是当前治疗面临的主要挑战,因此仍存在显著未满足的临床需求,需要新的治疗选择。
APG-2575是亚盛医药自主研发的新型口服Bcl-2选择性抑制剂,通过选择性抑制Bcl-2蛋白,可以恢复癌细胞的正常凋亡过程,从而达到治疗肿瘤的目的。
APG-2575适应症查询
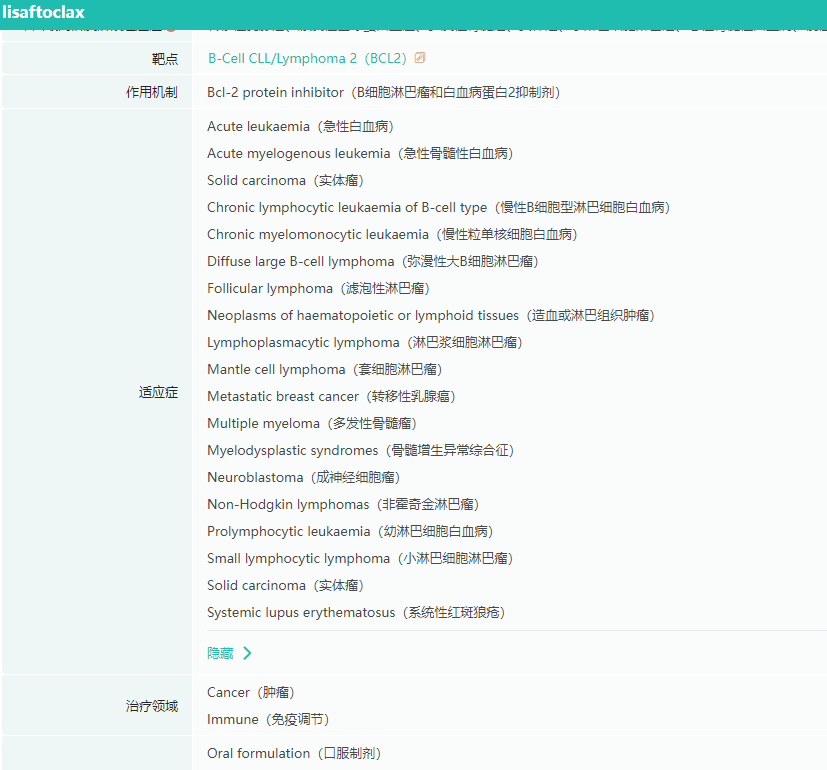
图片来源:药融云全球药物研发数据库
本次获批的APG-2575CG301是一项全球多中心、随机对照的注册3期临床试验,旨在评估APG-2575联合布鲁顿酪氨酸激酶抑制剂(BTKi)治疗既往接受治疗的CLL和SLL患者的疗效和安全性。该研究将于2023年下半年启动,预计将为这两种疾病的治疗提供新的有效药物和治疗策略。
2. 超10亿美元!恒瑞医药TSLP单抗实现海外授权
恒瑞医药发布公告称,其与美国OneBio公司达成协议,将其1类新药TSLP单抗SHR1905注射液项目有偿许可给OneBio。
SHR-1905是恒瑞医药自主研发的一款胸腺基质淋巴细胞生成素(TSLP)单克隆抗体,可以阻断炎症细胞因子的释放,抑制下游炎症信号的传导,最终改善炎症状态并控制疾病进展。由于TSLP作用于炎症级联反应的早期上游,SHR-1905有潜力适用于广泛的重度哮喘,不受表型(嗜酸性或过敏等)以及生物标志物的限制。
SHR-1905全球研发进度查询
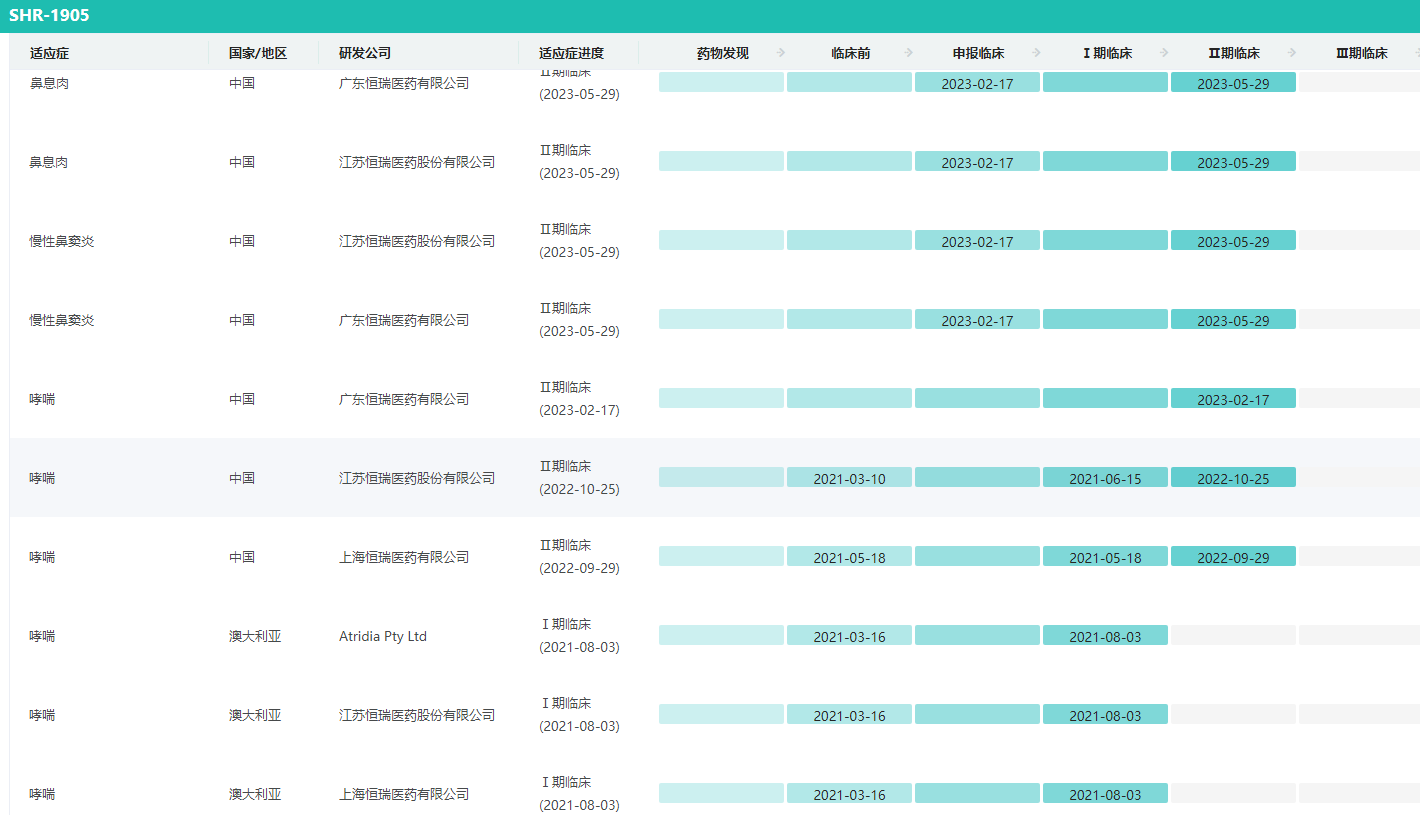
图片来源:药融云全球药物研发数据库
根据协议,该项交易的首付款和近期里程碑总计2500万美元。基于SHR-1905在美国、日本和约定的欧洲国家分别首次获批上市及实际年净销售额情况,OneBio将向恒瑞医药支付累计不超过10.25亿美元的研发及销售里程碑款。此外,OneBio将向恒瑞医药支付达到实际年净销售额两位数比例的销售提成。
3. 石药集团双特异性抗体IND申请获FDA批准
石药集团公告称,其附属公司NovarockBiotherapeutics研发的CLDN6-CD137双特异性抗体药物NBL-028的IND申请已获美国FDA批准,可开展用于治疗包括但不限于睾丸癌、卵巢癌、非小细胞肺癌及子宫内膜癌等CLDN6表达晚期肿瘤的临床试验。
药融云数据库显示,NBL-028是NovarockBiotherapeutics专有的T细胞衔接器平台NovaTE第一个进入临床阶段的项目。该平台是用于治疗癌症(特别是实体瘤)的下一代T细胞共激平台,经设计及优化可诱发持续性效应T细胞活化,解除肿瘤微环境(TME)中的免疫抑制,同时可降低包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICAN)及肝毒性等的全身毒性风险。
石药集团药物研发治疗领域分布
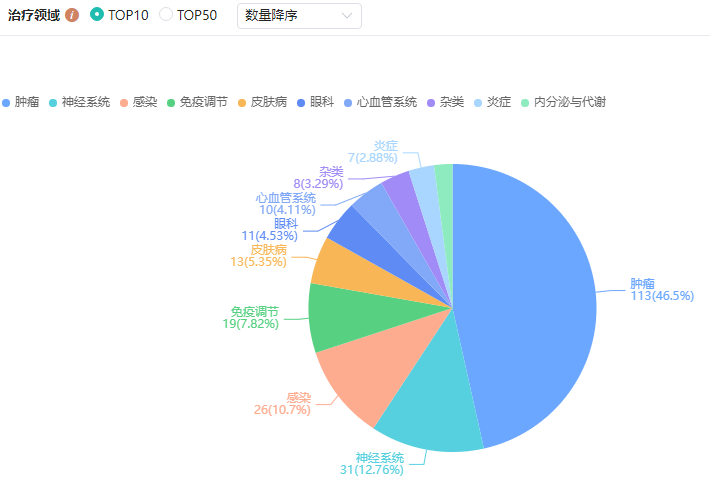
图片来源:药融云全球药物研发数据库
作为一款双特异性抗体在研新药,NBL-028可同时靶向全人源CLDN6和CD137。其中,Claudin6是claudin家族的一种紧密连接蛋白,高水平表达于多种人类恶性肿瘤中,但在正常组织中几乎没有或没有表达。CD137(或4-1BB)是诱导共激受体,为肿瘤坏死因子受体(TNFR)超家族的成员,在T细胞增殖、存活、细胞毒性活性、记忆形成及其他免疫细胞功能调节中发挥关键作用。
4. 甘李药业「甘精胰岛素」欧洲上市申请获受理
甘李药业宣布,其全资子公司甘李药业欧洲有限责任公司(Gan&LeePharmaceuticalsEurope)向欧洲药品管理局(EMA)递交了甘精胰岛素注射液的上市许可申请(MAA),适应症为糖尿病,并于近日收到欧洲EMA的正式受理通知,进入科学评估阶段。
糖尿病是一种常见的慢性疾病,患者的身体无法产生足够的胰岛素,或者无法正常使用胰岛素。当体内没有足够的胰岛素或细胞对胰岛素停止反应时,过多的葡萄糖会留在血液中,导致长期的健康问题,例如视力下降、肾脏疾病和心脏病等。
甘精胰岛素(商品名:长秀霖)是一种长效胰岛素类似物,也被称为基础胰岛素。它经过修饰后,可以在较长时间内提供稳定水平的血浆胰岛素。甘精胰岛素只需要每日注射一次,可以持续作用24小时,这种治疗方法非常方便,并且安全性高,非常符合人性化治疗的特点。
此外,甘精胰岛素吸收缓慢且作用时间长,患者血浆胰岛素水平不会出现明显峰值,因此可以很好地控制血糖。
<END>
想要了解更多国产创新药全球化动态、全球在研创新药积极/失败临床结果动态,以及获取药融云8月《全球在研新药与靶点月报》的全部内容,可以关注“药融云”公众号,后台回复“报告”关键词进行领取。



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论