5月24日,据CDE官网显示,正大天晴的帕妥珠单抗注射液上市申请获得受理。这是国内第2家申报上市的帕妥珠单抗生物类似药,首款来自齐鲁制药,国内首家谁能拿下?据悉,帕妥珠单抗的专利已快到期,国内外多家药企正在加入其生物类似药的研发中,目前尚无获批。
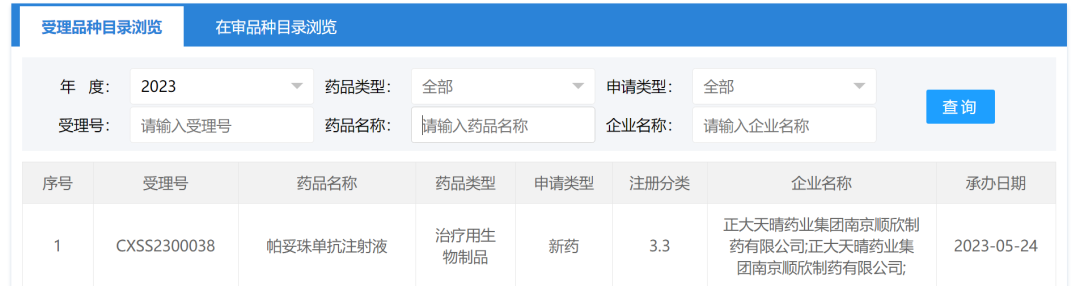
截图来源:CDE官网
帕妥珠单抗(Pertuzumab)是一款靶向HER2的重组人源化单克隆抗体,原研为罗氏的帕捷特(Perjeta)。帕妥珠单抗含人IgG1亚型框架,靶向HER-2的细胞外二聚化结构域(子域 II),从而阻断HER2与HER2之间以及HER2与其他HER家族成员之间的配体之间的二聚化作用,阻断细胞周期并诱导凋亡。
据药融云数据库显示,帕妥珠单抗最早于2012年6月获得美国FDA批准上市,用于治疗转移性乳腺癌,后又在2013年9月增加乳腺良性肿瘤适应症。在中国,罗氏的帕妥珠单抗于2018年12月获国家药监局批,进入国内上市销售。
- 2018年12月,帕妥珠单抗首个适应症在中国获批,用于联合曲妥珠单抗和化疗对高复发风险的HER2阳性早期乳腺癌患者开展辅助治疗。
- 2019年8月,帕妥珠单抗又获得NMPA批准,联合曲妥珠单抗和化疗,用于HER2阳性的局部晚期、炎性或早期乳腺癌患者(直径>2cm或淋巴结阳性)的新辅助治疗。
- 2019年12月,帕妥珠单抗在中国获批第三个适应症,联合曲妥珠单抗和多西他赛联用于尚未接受抗HER2治疗或化疗的HER2阳性转移性乳腺癌患者的一线标准治疗。
罗氏帕妥珠单抗基本信息
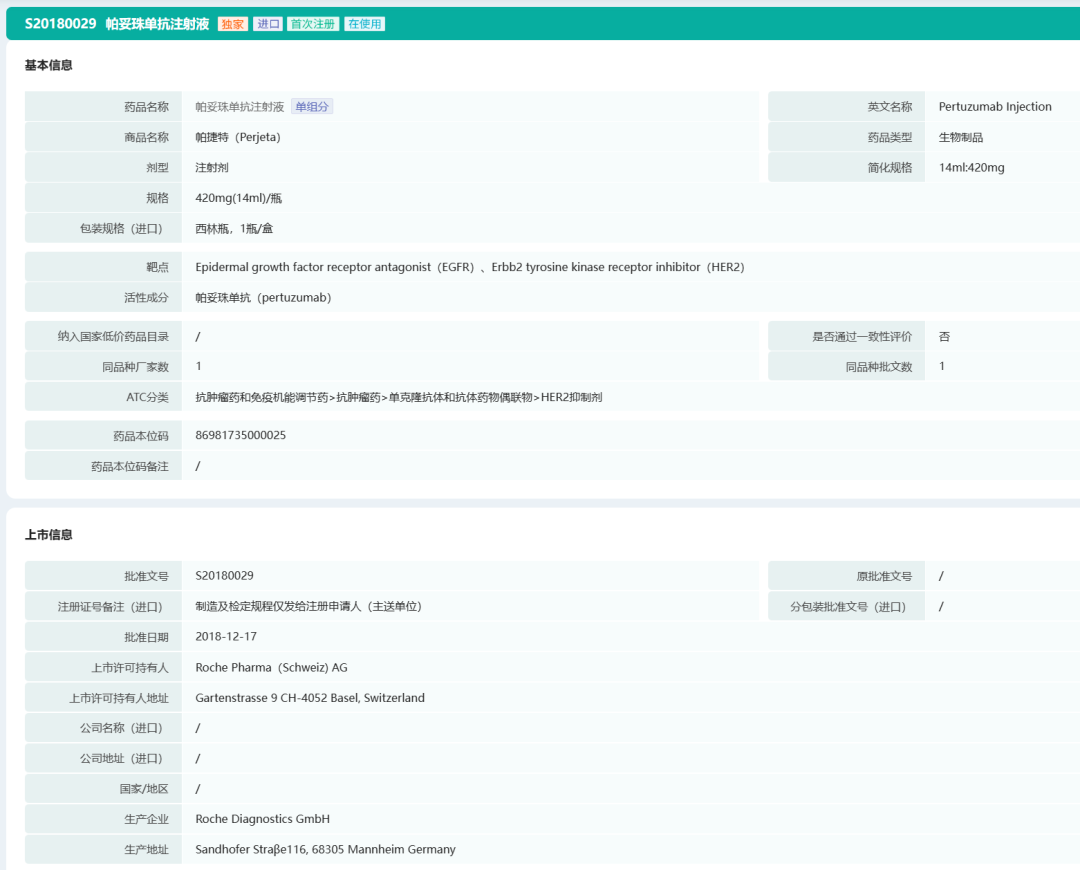
截图来源:药融云中国药品批文数据库
据药融云统计,帕妥珠单抗近年来在我国院内的销售额呈递增趋势,2021年暴增107.91%,达到26亿元,2022年增速放缓,销售额逼近30亿,在抗肿瘤药物榜单中相比去年上升了3名,排名第六(《2022年抗肿瘤药物TOP10出炉,罗氏四款单抗产品均上榜!》)。目前,帕妥珠单抗还是罗氏的独家品种,市场也由其独享。
截图来源:药融云全国医院销售数据库
据罗氏2022年财报显示,帕妥珠单抗在2022年的销售额为40.87亿瑞士法郎(约45.34亿美元),同比增长5%。可见,无论是在全球还是国内,帕妥珠单抗的销售市场均处于扩张模式。
据悉,帕妥珠单抗在欧盟的专利于2023年5月到期,美国专利将于2024年6月到期。目前,已有多家国内外药企加入帕妥珠单抗生物类似药的研发中,尚无生物类似药上市。
国内布局帕妥珠单抗生物类似药的企业中,2家药企进展较快,已递交了上市申请。今年1月10日,齐鲁制药向CDE递交了其3.3类治疗用生物制品帕妥珠单抗注射液的新药上市申请,为国内首家。此次正大天晴又递交,两者谁能抢先胜出?进度值得关注。此外,石药集团、复宏汉霖、双鹭药业和海正药业的帕妥珠单抗生物类似药均已进入III期临床阶段。
信息参考:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yry-public-oss.pharnexcloud.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)















 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论