
近期,礼来公司在欧洲糖尿病研究协会(EASD)第 59 届年会上公布了关于Tirzepatide的最新研究数据。研究结果显示,Tirzepatide (10 mg,15 mg)达到了共同主要终点和所有关键次要终点,在中国成人肥胖和超重患者中实现了显著且具有临床意义的体重减轻。该研究为支持Tirzepatide用于成人肥胖和超重患者长期体重管理的有效性与安全性进一步增加了强有力的证据。
声明:
1. Tirzepatide为研究中的药品,尚未在中国获批
2. 礼来不推荐任何未获批的药品/适应症使用
SURMOUNT-CN III期临床试验结果1于 10月 3日在 EASD以简短的口头讨论形式披露。
SURMOUNT-CN是一项多中心、随机、双盲、平行、安慰剂对照的III期临床试验,纳入肥胖(BMI≥28 kg/m2)或伴有至少一种合并症的超重(BMI≥24 kg/m2)的中国成人受试者,旨在低热量饮食和增加运动的基础上对比Tirzepatide 与安慰剂在体重减轻方面的有效性和安全性。研究入组了210名中国患者,以1:1:1的比例随机分组,分别接受Tirzepatide 10 mg或15 mg或安慰剂每周一次治疗。共同主要终点为在52周时tirzepatide(10mg和/或15mg)相较于安慰剂在体重的变化百分比和达到体重减轻≥5%的患者比例方面的优效性。
基线时受试者平均体重为91.8kg、平均BMI为32.3kg/m2、平均腰围为104.8cm。研究结果显示,
- 第52周时 Tirzepatide 10mg组、15mg组平均体重自基线分别降低14.4%、19.9%,均优效于安慰剂组(降低2.4%)。
- Tirzepatide 10mg组、15mg组达到体重减轻≥5%的受试者比例分别为91.4%、92.7%,优效于安慰剂组(29.4%)。
- 52周时Tirzepatide 10mg组、15mg组平均腰围自基线分别减少11.9 cm、16.4cm,优效于安慰剂(减少2.7cm)。
SURMOUNT-CN试验中Tirzepatide的总体安全性与先前试验报道相似,未发现新的安全性信号。Tirzepatide组最常报告的治疗期间不良事件为胃肠道不良事件,其严重程度大多为轻度至中度,主要发生在剂量递增期间。
关于Tirzepatide
每周一次注射的GIP/GLP-1受体激动剂Tirzepatide是一种单分子多肽,可结合并激活人体天然肠促胰素受体 GIP 受体和 GLP-1受体。GIP受体和GLP-1 受体均表达于大脑中调节食欲的重要区域。Tirzepatide通过减少热量摄入和调节食欲来减少食物摄入、降低体重并降低脂肪含量;此外,Tirzepatide 已被证实可调节脂质利用。Tirzepatide对肥胖或伴有体重相关合并症的超重成人的长期体重管理目前处于III期临床开发阶段。
Tirzepatide基本信息
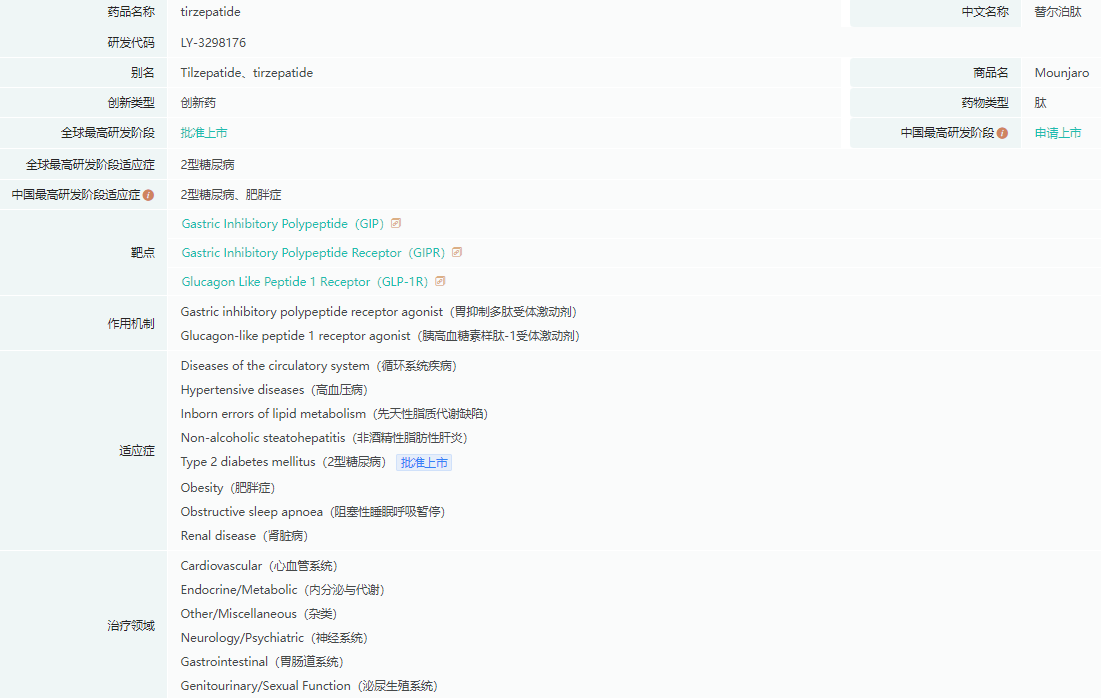
截图来源:药融云全球药物研发数据库
此前,Tirzepatide(Tirzepatide)已于 2022 年 5 月 13 日在FDA 获批用于在饮食控制和运动基础上,改善成人2型糖尿病患者的血糖控制。Tirzepatide对于肥胖或超重伴有射血分数保留的心力衰竭(HFpEF)、阻塞性睡眠呼吸暂停 (OSA) 和非酒精性脂肪性肝炎 (NASH) 患者的潜在治疗也在研究中。此外,Tirzepatide 针对慢性肾脏病 (CKD) 和肥胖患者发病率和死亡率 (MMO) 的研究也在进行中。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论