根据药融云数据库显示。2021年4月,美国FDA共批准:
- 4款创新药,包含2个新分子实体,2个单抗。Nextstellis、Jemperli、Zynlonta这3款药物为全球首次获批上市。
- 2款改良型新药。
71款仿制药,其中15个仿制药为暂定批准。中国药企获10个ANDA批文,涉及复星、齐鲁、石药、人福等9个企业。
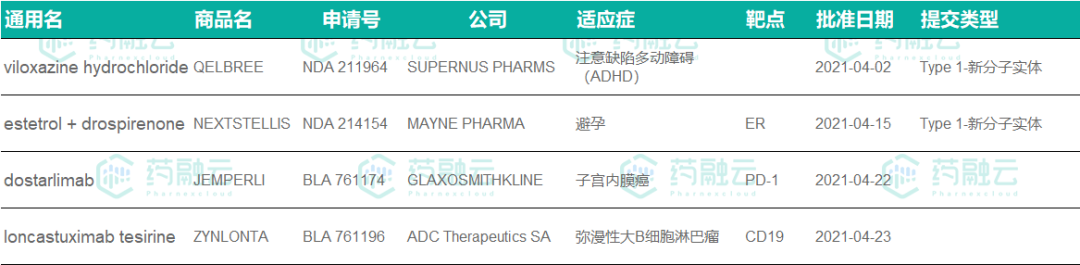
4月FDA批准的创新药
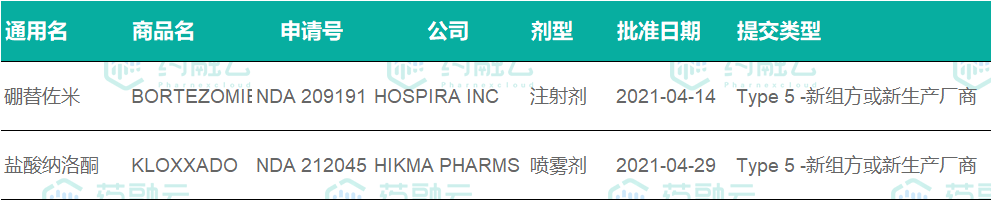
4月FDA批准的改良型新药
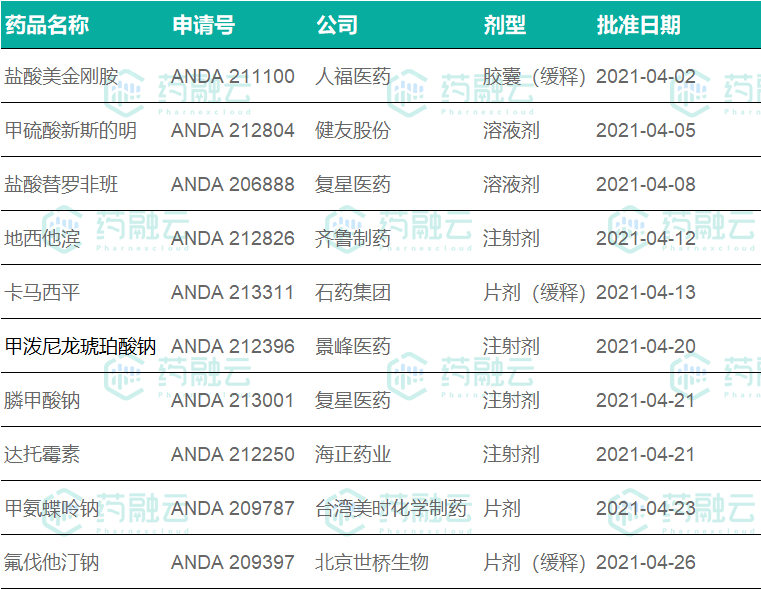
4月中国药企获批的ANDA批文
1、Qelbree
4月2日,FDA批准Supernus公司Qelbree(viloxazine缓释胶囊) 上市,用于治疗6-17岁儿童注意力缺陷多动障碍(ADHD)。Qelbree是近10年来FDA批准的首个新型非兴奋剂类ADHD药物。
Qelbree是 Supernus Pharmaceuticals自主研发一种具有选择性5-羟色胺调节活性的去甲肾上腺素再摄取抑制剂(NET),该药物已在欧洲作为抗抑郁药物使用多年,其安全性也得到了广泛验证。
Qelbree的获批是基于一项针对儿童患者4个III期临床试验(P301、P302、P303、P04)项目的数据支持,该项目评估了Qelbree对超过1000例 6-17岁儿童ADHD患者的疗效。研究结果显示,4项研究均达到主要终点,Qelbree不同剂量组患者ADHD 5级评定量表(ADHD Rating Scale-5)评分较基线变化值与安慰剂组有显著性差异,患者多动/冲动和注意力不集中症状得到显著改善。
Qelbree在ADHD成人中进行的III期研究也于2020年12月取得积极结果,将于3下半年递交Qelbree治疗成人ADHD的补充新药申请。
Qelbree的获批将进一步对礼来的 Strattera(阿托西汀)造成威胁。Strattera也是一款去甲肾上腺素再摄取抑制剂,最早于2002年7月被FDA 批准用于治疗ADHD。与普遍采用的传统中枢神经兴奋剂相比,阿托西汀具有极其出色的疗效和安全性,在国际上已得到广泛认可和应用,已被推荐为治疗 ADHD 的一线药物,目前FDA已批准了多款阿托西汀仿制药。
2、Nextstellis
4月15,美国FDA批准Mayne Pharma公司的Nextstellis(屈螺酮和雌甾醇复方片剂)上市,用于避孕。Nextstellis是首款包含雌甾醇的避孕药物,它是一种天然存在的雌激素,目前可以基于植物原料进行生产。它具有独特的作用机制。这也是美国FDA超过50年来首次批准了一款新的雌激素。
在针对Nextstellis开展的临床研究中共纳入了超过3700例16-50岁多类别女性人群,其中包括了转换避孕措施以及BMI高达35kg/m2的女性等。临床结果显示,Nextstellis在所有研究亚组(按年龄、BMI指数和既往激素避孕药使用情况)中均表现出避孕有效性。而且,Nextstellis的安全性也可以得到保障,包括降低出血频率和良好的出血特征。Nextstellis的耐受性良好,对甘油三酯、胆固醇和葡萄糖以及体重和内分泌标志物的影响也较小。
3、Jemperli
2021年4月22日,美国FDA批准了葛兰素史克的抗PD-1抗体Jemperli(dostarlimab)用于治疗复发性或晚期子宫内膜癌患者。Jemperli是第一个被批准用于治疗子宫内膜癌的PD-1疗法,同时也是FDA批准的第七款PD-(L)1药物,此前,FDA授予了dostarlimab突破性药物资格(BTD)和优先审评资格。目前,Jemperli也正在接受欧盟EMA的审查。
Jemperli是一款人源化抗PD-1单克隆抗体,与PD-1受体结合后可以阻断其与配体PD-L1和PD-L2的相互作用。

此次的获批是基于一项多中心、多队列、开放标签的GARNET研究。入组人群为71例错配修复缺陷复发或晚期子宫内膜癌患者,这些患者的疾病在含铂方案治疗期间或治疗后发生进展。研究的主要疗效指标为总客观缓解率(ORR)和中位缓解期(DOR)。研究数据显示:中位随访时间为14.1个月;ORR为42.3%,完全缓解(CR)为12.7%,部分缓解(PR)为29.6%,DOR尚未达到;在病情缓解的患者中,93%的患者缓解持续时间≥6个月。
4、Zynlonta
2021年4月23日,FDA批准ADC Therapeutics SA抗体偶联药物Zynlonta(Loncastuximab tesirine)治疗弥漫性大B细胞淋巴瘤和套细胞淋巴瘤。Zynlonta第一款也是唯一一款CD19靶向ADC药物。2017年6月,FDA授予Zynlonta孤儿药资格。
Zynlonta 是一个靶向CD19的ADC药物,单克隆IgG1 kappa 抗体成分与人CD19(B谱系细胞表面表达的跨膜蛋白)结合,小分子成分是SG3199,一个PBD二聚物和烷基化剂。

FDA批准Zynlonta是基于LOTIS-2(NCT03589469)是一项开放标签单臂临床试验的关键结果数据。入组人群为145名复发或者是经过至少2次先前的全身性治疗后仍然难以控制的弥漫性大B细胞淋巴瘤(DLBCL)成年患者,试验排除了具有大肿块和活跃中枢神经系统淋巴瘤的患者。患者每3周接受0.15毫克/千克的Zynlonta,共2个周期,然后每3周接受0.075毫克/千克的Zynlonta在接下来的周期,接受治疗直至病情发展或出现无法接受的毒性。
结果显示,Zynlonta的整体缓解率达到了了48.3%,完全缓解率达到了24.1%,部分缓解率达到了24.1%。在得到缓解的70例患者中,中位缓解时间为10.3个月。
中国药企的ANDA批文
近年来,我国的制剂出海逐步走向规范。美国是全球第一大药品市场,也是第一大仿制药市场,常被视为仿制药企业出海的第一站。4月、齐鲁、石药、人福、健友以及复星医药旗下GLAND PHARMA LTD等共取得10个ANDA批文。
盐酸美金刚胺—人福医药
宜昌人福于2017年提交盐酸美金刚缓释胶囊的ANDA申请,累计研发投入约为770万元人民币。Allergan公司持有盐酸美金刚缓释胶囊的七项专利,到期日分别为2026年5月22日、2029年9月24日,截至目前无任何一方认为宜昌人福的盐酸美金刚缓释胶囊侵犯上述专利权。
甲硫酸新斯的明—健友股份
截至目前,健友在甲硫酸新斯的明注射液研发项目上已投入研发费用约人民币474.81 万元。
新批准产品近期将安排在美国上市销售,有望对公司经营业绩产生积极影响。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论