
11月16日,恒瑞医药2023研发日活动在上海浦东成功举办。
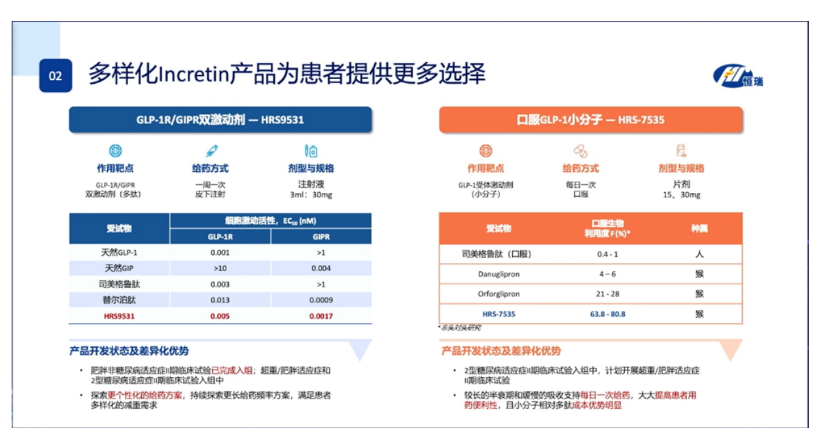
慢病管理方面,恒瑞共有58款创新产品在研。在降糖/减重领域,GLP-1R/GIPR双激动剂HRS9531、口服GLP-1小分子HRS-7535在会上进行了重点介绍,体现了恒瑞医药对于这个千亿市场的重视。
狂飙的”GLP-1R”,恒瑞已有5款新药进入临床
在医药「寒冬」的冷风呼啸之中,GLP-1 正逆流直上,呈现炙手可热之姿。在包括肥胖在内的全代谢谱系适应症布局加持之下,这类药物已经火出医药圈外。行业内的人直呼:完蛋!我被GLP-1包围了。
截止目前,诺和诺德和礼来处于全球GLP-1R药物研发第一梯队,不仅手握重磅上市药物(利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽),其余多条管线已进入临床Ⅱ/Ⅲ期,不久后将迎来收获期。
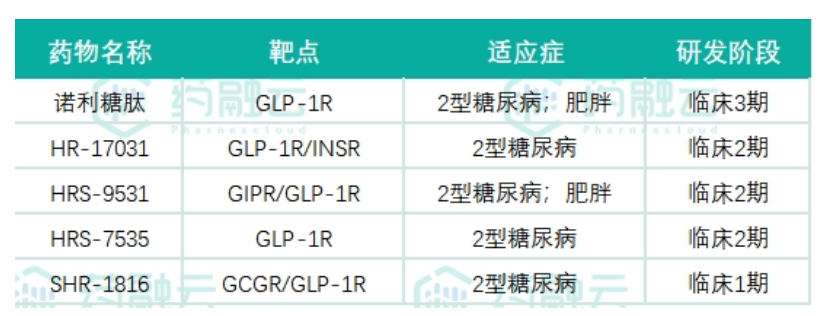
中国已成为全球研发最卷的地区之一,研发布局以GLP-1R单靶点布局为主,部分在该领域布局深厚的公司开展双靶点/三靶点新药的临床研究。国内目前,恒瑞医药、信达生物、华东医药……处于国产GLP-1R新药研发的相对领先的位置。其中恒瑞医药已有5款GLP-1R相关新药进入临床研究,两款双靶点药物引人注目:GIPR/GLP-1R双靶点激动剂HRS9531、GCGR/GLP-1R双靶点激动剂 SHR-1816。
管线1:GLP-1R单靶新药诺利糖肽
诺利糖肽为恒瑞医药开发的利拉鲁肽的衍生物,一天注射一次,与目前已上市的GLP-1受体激动剂利拉鲁肽等相比,诺利糖肽不良反应发生率低。根据药融云中国临床试验数据库显示,诺利糖肽已经完成了肥胖和2型糖尿病的2期临床,三期试验开展在即。
目前,单靶点的GLP-1药物非常难做出较司美格鲁肽优效,且国内有众多生物类似药/仿制药企虎视眈眈等待司美格鲁肽专利到期。恒瑞的诺利糖肽需要每日注射一次,虽然不良反应发生率较利拉鲁肽低,但与司美格鲁肽(每周注射一次)相比,劣势明显,市场空间可能有限。
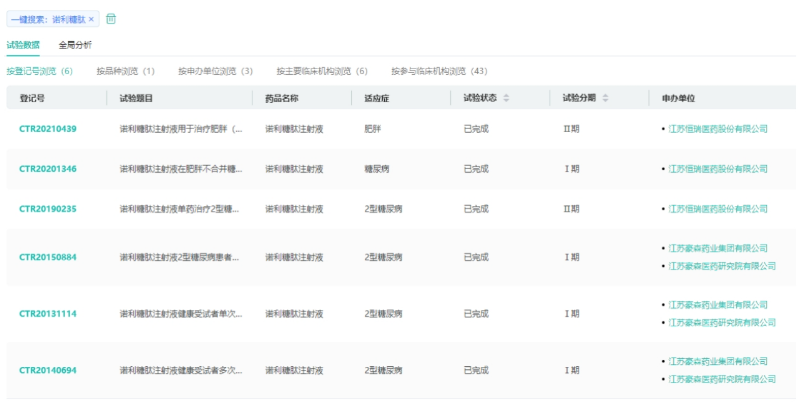
来源:药融云中国临床试验数据库
管线2:GLP-1R /胰岛素复方制剂HR-17031
HR17031是诺利糖肽与胰岛素的复方制剂,其糖尿病适应症目前正处于2期临床阶段。值得一提的是,目前临床阶段尚无国内企业开发同类药物。
来自诺和诺德的 Xultophy(德谷胰岛素+利拉鲁肽)和赛诺菲的 Soliqua(利司那肽+甘精胰岛素)2 款进口药是国内获批仅有的同类药物,获批时间在 2021 和 2023 年。诺和诺德还开发了司美格鲁肽+长效胰岛素 Icodec 的复方制剂 IcoSema,国内已启动 III 期临床。GLP-1R + 胰岛素的组合,能够给糖尿病患者带来更优效的治疗,HR17031有望占据一定的市场。
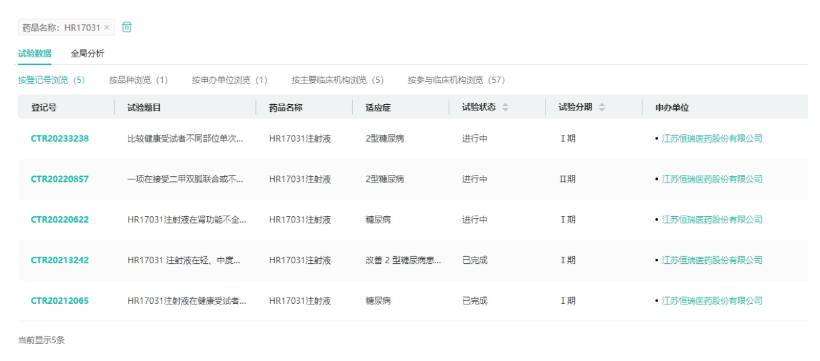
来源:药融云中国临床试验数据库
管线3:GIPR/GLP-1R双靶新药HRS-9531
HRS9531是一款靶向GIPR/GLP-1R的在研新药。GLP-1和GIP是两种天然的肠促胰素,研究表明GIP可以减少食物摄入、增加能量消耗,从而减轻体重。当GIP与GLP-1受体激动剂联合使用时,可能会对患者血糖和体重产生更大的影响。2023年5月5日,CDE官网显示,恒瑞医药1类新药HRS9531注射液已获批临床,用于减重。目前,HRS9531肥胖和2型糖尿病的2期临床试验正在积极推进中。
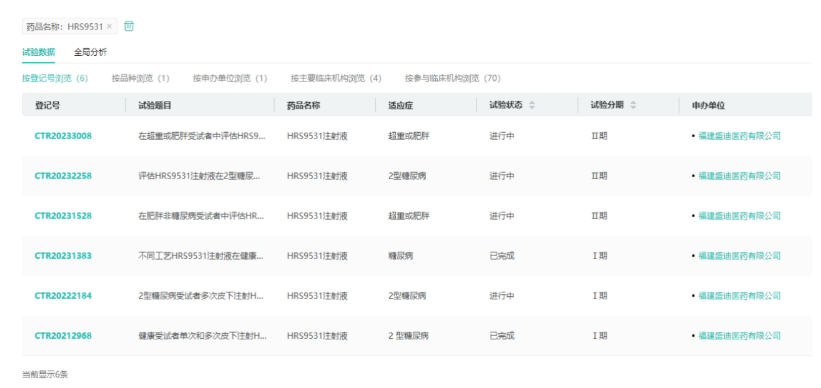
来源:药融云中国临床试验数据库
第83届美国糖尿病协会科学会议上,恒瑞公布了GIPR/GLP-1R激动剂HRS9531的I期临床研究数据。
2021年12月,恒瑞启动了这项随机、双盲、剂量递增、安慰剂对照的I期临床研究(NCT05152277),旨在评估单次和多次皮下注射HRS9531注射液用于健康受试者的安全性、耐受性、药代动力学及药效学性质。NCT05152277(摘要编号 765-P)是HRS9531在健康受试者中的 1 期单次(SAD)和多次剂量递增研究(MAD)。SAD部分的受试者体重呈剂量依赖性减轻,第8天时8.1mg组的平均减轻体重3.8kg(4.9%)。而在MAD部分,4周后0.9-5.4mg组的平均体重减轻4.3-7.7kg(6.7%-9.3%);第36天5.4mg组减重幅度最大,达到8.0kg(10.0%)。
2023年8月21日,礼来制药GIPR/GLP-1R双靶点激动剂替尔泊肽(Tirzepatide)注射液减重适应症的上市申请获得NMPA受理。2022年9月7日,替尔泊肽降糖适应症在国内递交上市申请。HRS9531与替尔泊肽属于同靶点药物,替尔泊肽在国外的优秀市场表现展现出GIPR/GLP-1R双靶点的巨大商业潜力,期待两款药能够同台竞技。
管线4:口服GLP-1R新药HRS-7535
HRS-7535是一种新型口服小分子GLP-1R药物。临床前研究发现,在无严格限食的情况下,HRS-7535可明显改善葡萄糖耐量,促进胰岛素分泌,减少摄食量。目前,不论是已上市还是正处临床阶段的GLP-1R药物,多是大分子蛋白,给药方式还是以皮下注射为主,导致患者依从性差。因此,更为方便的口服GLP-1R药物成为各大药企布局的对象。
 来源:药融云中国临床试验数据库
来源:药融云中国临床试验数据库
第83届美国糖尿病协会科学会议上,恒瑞公布了口服GLP-1R药物HRS-7535的I期临床研究数据(NCT05347758)。参与SAD和MAD的受试者各有24例。两组中治疗期间出现的不良事件(TEAE)均为轻度。PK大致成比例。在SAD中,HRS-7535给药范围内的中位达峰时间(Tmax)为5.98~5.99h,末端清除半衰期(t1/2)为5.28~9.08h。
在MAD中,第28天时HRS-7535给药范围内的中位Tmax为5.98~10.98h,几何平均t1/2为6.48~8.42h。在MAD中,使用HRS-7535的受试者第29天时的体重自基线平均下降4.38 kg。无论SAD还是MAD,HRS-7535均具有可接受的安全性和良好的PK/PD;此外,在健康受试者中还可观察到体重明显下降。这些发现支持HRS-7535在代谢综合征患者中的进一步临床探索。
管线5:GCGR/GLP-1R双靶新药SHR-1816
恒瑞医药双靶GCGR抗体/GLP-1融合蛋白SHR-1816注射液在2022年3月获得临床批准,用于治疗成人Ⅰ型和Ⅱ型糖尿病,目前国内外尚无同靶点药物上市,该项目累计研发投入超过4359万元。目前SHR-1816已经开展了1期临床,主要研究目的:在健康受试者中评价SHR-1816皮下注射单次给药剂量递增和多次给药的安全性和耐受性。次要研究目的:在健康受试者中评价SHR-1816皮下注射单次给药剂量递增和多次给药的药代动力学(PK)、药效学(PD)特征和免疫原性。
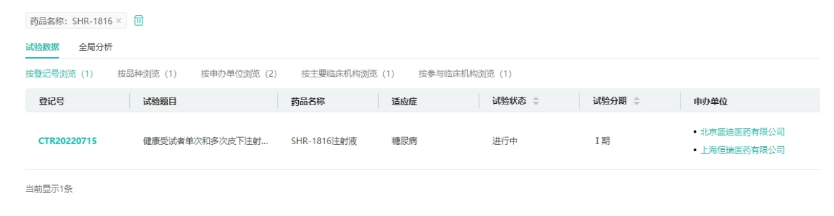
来源:药融云中国临床试验数据库
研究证实,GCGR/GLP-1R双重激动剂能激活GLP-1R提高胰岛素分泌并且降低食物摄入,并通过激活GCGR起到降低炎症和脂肪生成。目前,针对这两个靶点,多个药企已布局治疗糖尿病、肥胖的药物。在全球范围,Mazdutide(玛仕度肽、IBI362)处于GLP-1R/GCGR研发的第一梯队。
玛仕度肽(研发代号:IBI362)是信达生物与礼来(Eli Lilly and Company)共同推进的一款GLP-1R/GCGR双重激动剂。该产品已在多项临床研究中展现出良好的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。2023年10月30日,信达生物宣布,胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂玛仕度肽高剂量9mg在中国肥胖受试者中的2期临床研究继24周主要研究终点达成后,完成48周治疗期,玛仕度肽9mg组体重较基线的平均变化值与安慰剂组的差值达−17.8kg(近36斤)。
总结
利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽四款产品的商业化成功点燃了GLP-1R赛道的研发热情。目前,诺和诺德和礼来占据了近90%GLP-1R的市场份额,先发优势、产能优势和管线厚度等Buff叠加,使得后续入场的药企压力巨大。如果后续不能在药效、服药周期等指标上展现出优势,而价格又不能与仿制药比拼,基本将陷入还未入局就将出局的窘境。作为国产新药研发“一哥”的恒瑞,重仓了GLP-1R赛道,期待其多款GLP-1R药物未来的表现。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论